题目内容
17.分析化学反应:2H2S+3O2$\frac{\underline{\;点燃\;}}{\;}$2SO2+2H2O,化学反应前后化合价有改变的元素是( )| A. | 硫和氧 | B. | 氢和氧 | C. | 只有硫 | D. | 氢、硫、氧 |
分析 根据单质中元素的化合价为0、在化合物中正负化合价代数和为零,结合各化学式进行解答本题.
解答 解:氢元素显+1价,设H2S中硫元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)×2+x=0,则x=-2价.
氧元素显-2价,设SO2中硫元素的化合价是y,根据在化合物中正负化合价代数和为零,可得:y+(-2)×2=0,则y=+4价.
硫元素的化合价由-2价变为+4价.
根据单质中元素的化合价为0,O2属于单质,故氧元素的化合价为0;生成物二氧化硫、水中氧元素显-2价.氧元素的化合价由0变为-2价.
故在反应前后,化合价发生了变化的元素S、O.
故选A.
点评 本题难度不大,掌握利用化合价的原则(单质中元素的化合价为0、在化合物中正负化合价代数和为零)计算指定元素的化合价的方法即可正确解答本题.

练习册系列答案
 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
7.下列各组物质中括号内物质为杂质,写出除去杂质的方程式(或方法).
| 主要物质(杂质) | 化学方程式(或方法) |
| FeSO4(CuSO4) | |
| KCl(K2CO3) | |
| KCl(K2SO4) | |
| CO2(CO) | |
| CO(CO2) | |
| NaNO3(CuSO4) | |
| KNO3(NaCl) |
8.下列有关燃烧和灭火的说法中,不正确的是( )
| A. | 风助火威--为燃烧提供足够多的氧气 | |
| B. | 杯水车薪一水少了不能降低温度使温度低于可燃物的着火点 | |
| C. | 釜底袖薪一隔离可燃物可以灭火 | |
| D. | 水火不容--用水可以灭火,是因为降低了可燃物的着火点 |
5. 我们学习过常见气体的实验室制法,知道了制取气体的一般思路和方法.
我们学习过常见气体的实验室制法,知道了制取气体的一般思路和方法.
(1)实验室制取气体时,确定发生装置需要考虑的两个因素有AC(填序号);
A.反应物的状态 B.气体的密度
C.反应的条件 D.气体的溶解性
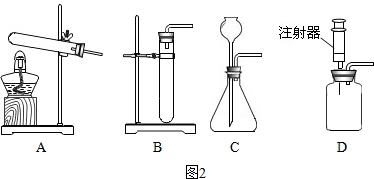
(2)某实验室的仪器柜里有如图1的仪器:写出图中标号①仪器的名称长颈漏斗.实验室用大理石和稀盐酸制备并收集一瓶干燥的二氧化碳时,不可能选择的仪器是②⑤(填序号);
(3)老师问:“如果实验室在没有大理石的情况下能否用碳酸钠粉末与稀盐酸来制取二氧化碳呢?”,大多数同学认为可以,反应的化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑.为了完成该实验,有四位同学组装了以下发生装置,你认为最合适的一套装置是D(填序号),该装置的最大优点是能控制反应速率.
(4)某实验小组还利用下图装置对实验室制取CO2的速率快慢进行了研究.他们实验时所用的试剂和使用的反应条件如下表所示:
实验小组同学设计的实验方案部分如下表,请根据表中信息帮助填写完整.
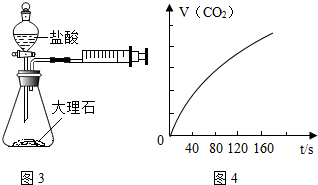 实验探究时,他们每次收集CO2气体均为40mL,则实验中他们还应记录的实验数据是收集40mL的CO2所需要的时间.图4是根据某次实验数据作出的CO2和时间变化的关系曲线,请分析在80秒以后,产生CO2逐渐减慢的可能原因:80秒后,盐酸反应了一部分,盐酸的浓度变低,反应速率变慢.
实验探究时,他们每次收集CO2气体均为40mL,则实验中他们还应记录的实验数据是收集40mL的CO2所需要的时间.图4是根据某次实验数据作出的CO2和时间变化的关系曲线,请分析在80秒以后,产生CO2逐渐减慢的可能原因:80秒后,盐酸反应了一部分,盐酸的浓度变低,反应速率变慢.
 我们学习过常见气体的实验室制法,知道了制取气体的一般思路和方法.
我们学习过常见气体的实验室制法,知道了制取气体的一般思路和方法.(1)实验室制取气体时,确定发生装置需要考虑的两个因素有AC(填序号);
A.反应物的状态 B.气体的密度
C.反应的条件 D.气体的溶解性
(2)某实验室的仪器柜里有如图1的仪器:写出图中标号①仪器的名称长颈漏斗.实验室用大理石和稀盐酸制备并收集一瓶干燥的二氧化碳时,不可能选择的仪器是②⑤(填序号);
(3)老师问:“如果实验室在没有大理石的情况下能否用碳酸钠粉末与稀盐酸来制取二氧化碳呢?”,大多数同学认为可以,反应的化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑.为了完成该实验,有四位同学组装了以下发生装置,你认为最合适的一套装置是D(填序号),该装置的最大优点是能控制反应速率.

(4)某实验小组还利用下图装置对实验室制取CO2的速率快慢进行了研究.他们实验时所用的试剂和使用的反应条件如下表所示:
| 盐酸 | 大理石 | 温度条件 |
| 5% | 细颗粒 | 20℃ |
| 10% | 粗颗粒 | 40℃ |
| 每次用量均20mL | 每次用量均5g |
| 实验编号 | 温度 | 大理石规格 | HCl浓度 | 探究目的 |
| ① | 20℃ | 粗颗粒 | 5% | (I)实验①和②探究浓度对反应快慢的影响; (II)实验②和④探究温度对反应快慢的影响; (III)实验①和③③探究大理石粗、细对反应快慢的影响. |
| ② | 20℃ | 粗颗粒 | 10% | |
| ③ | 20℃ | 细颗粒 | 5% | |
| ④ | 40℃ | 粗颗粒 | 10% |
 实验探究时,他们每次收集CO2气体均为40mL,则实验中他们还应记录的实验数据是收集40mL的CO2所需要的时间.图4是根据某次实验数据作出的CO2和时间变化的关系曲线,请分析在80秒以后,产生CO2逐渐减慢的可能原因:80秒后,盐酸反应了一部分,盐酸的浓度变低,反应速率变慢.
实验探究时,他们每次收集CO2气体均为40mL,则实验中他们还应记录的实验数据是收集40mL的CO2所需要的时间.图4是根据某次实验数据作出的CO2和时间变化的关系曲线,请分析在80秒以后,产生CO2逐渐减慢的可能原因:80秒后,盐酸反应了一部分,盐酸的浓度变低,反应速率变慢.
12.实验开放日,某化学兴趣小组在学校实验室进行酸和碱的化学性质探究实验,邀你一同参加.
(1)探究稀硫酸与氢氧化钠是否发生化学反应
化学实验常伴随明显的实验现象,但稀硫酸与氢氧化钠溶液反应无明显现象,化学兴趣小组经过讨论,按图示操作进行实验:

当滴入几滴酚酞试液后,溶液由无色变为红色,根据上述实验中颜色变 化,可确定稀硫酸与氢氧化钠溶液发生了化学变化,反应的化学方程式 为2NaOH+H2SO4=Na2SO4+2H2O.
(2)探究上述稀硫酸与氢氧化钠溶液反应后烧杯中的硫酸是否过量
根据上述反应过程中溶液变成无色,不能确定稀硫酸是否过量,同学们又分别选取氯化钡溶液、紫色石蕊试液设计实验方案,请你判断并分析:
上述设计的实验方案中,正确的是方案二(填“方案一”或“方案二”).
另外一个实验方案错误的原因是NaOH和H2SO4反应后生成的硫酸钠也能和BaCl2反应产生白色沉淀BaSO4.
请你设计一个确定稀硫酸是否过量的实验方案,你选用的药品是锌粒(或碳酸钠等),实 验现象及结论是若有气体放出,证明稀硫酸过量,反之稀硫酸不过量.
(1)探究稀硫酸与氢氧化钠是否发生化学反应
化学实验常伴随明显的实验现象,但稀硫酸与氢氧化钠溶液反应无明显现象,化学兴趣小组经过讨论,按图示操作进行实验:

当滴入几滴酚酞试液后,溶液由无色变为红色,根据上述实验中颜色变 化,可确定稀硫酸与氢氧化钠溶液发生了化学变化,反应的化学方程式 为2NaOH+H2SO4=Na2SO4+2H2O.
(2)探究上述稀硫酸与氢氧化钠溶液反应后烧杯中的硫酸是否过量
根据上述反应过程中溶液变成无色,不能确定稀硫酸是否过量,同学们又分别选取氯化钡溶液、紫色石蕊试液设计实验方案,请你判断并分析:
| 实验方案 | 实验步骤 | 实验现象 | 实验结论 |
| 方案一 | 取样,滴入适量的氯化钡溶液 | 出现白色沉淀 | 稀硫酸过量 |
| 方案二 | 取样,滴入几滴紫色石蕊试液 | 溶液变红 | 稀硫酸过量 |
另外一个实验方案错误的原因是NaOH和H2SO4反应后生成的硫酸钠也能和BaCl2反应产生白色沉淀BaSO4.
请你设计一个确定稀硫酸是否过量的实验方案,你选用的药品是锌粒(或碳酸钠等),实 验现象及结论是若有气体放出,证明稀硫酸过量,反之稀硫酸不过量.
2.用数轴可以比较直观地表示某些科学知识.下列用数轴表示的科学知识,错误的是( )
| A. |  部分金属活动性顺序 | B. |  生物的分类等级 | ||
| C. |  部分元素的原子序数 | D. |  空气中部分成分的体积分数 |
9.以下自然资源的利用过程中,发生了化学变化的是( )
| A. | 海水晒盐 | B. | 风力发电 | C. | 煤的干馏 | D. | 石油分馏 |
7.下列有关材料的说法错误的是( )
| A. | 铁在潮湿的空气中容易生锈 | B. | 大理石、金刚石都是无机材料 | ||
| C. | 铝合金比铝的强度和硬度高 | D. | 合金、合成纤维都是有机合成材料 |
