题目内容
13.下表是NaCl、KCl、NH4Cl、KNO3,在不同温度时的溶解度,根据表中数据间答问题| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 | |
| 溶解度/g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 | 38.4 | 39.0 | 39.8 |
| KCl | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 45.5 | 48.3 | 51.1 | 54.0 | 56.7 | |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.1 | 45.8 | 50.4 | 55.2 | 60.2 | 65.6 | 71.3 | 77.3 | |
| KNO3 | 13.3 | 20.4 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | 169 | 202 | 246 | |
(2)以上四种物质中温度变化对溶解度的彩响最小的物质是NaCl;
(3)以上四种物质在农业上可用作复合肥的是KNO3;
(4)从含有少量的NaCl的KNO3溶液中得到KNO晶体的结晶较纯的方法是降温结晶;
(5)分别把1OO℃的NaCl、KCl、NH4Cl、KNO3饱和溶液降温至10℃时所得溶液的溶质质量分数最小的是硝酸钾溶液.
分析 (1)根据表格信息来分析;
(2)根据图表中四种物质的溶解度进行解答;
(3)复合肥料是指含有两种或两种以上营养元素的肥料;
(4)在考虑分离方法时通常要参考物质的溶解度受温度变化影响的大小.
(5)根据图表信息以及饱和溶液中溶质质量分数的计算方法来分析.
解答 解:(1)30℃时,MH4Cl的溶解度为41.1g;故填:41.1g;
(2)根据表格可以看出,氯化钠的溶解度随温度的升高变化不大,故填:NaCl;
(3)硝酸钾的组成中含有氮元素和钾元素,属于复合肥料,故填:KNO3;
(4)如果溶解度受温度影响较大的物质从溶液中结晶析出的方法是冷却热饱和溶液,如果溶解度受温度影响不大的物质从溶液中结晶析出的方法是蒸发溶剂.由于硝酸钾的溶解度受温度影响较大,氯化钠的溶解度受温度影响比较小,所以用降温结晶的方法提纯;故填:降温结晶;
(5)由表格信息可知,四种物质的溶解度均随着温度的降低而减小,故把1OO℃的NaCl、KCl、NH4Cl、KNO3饱和溶液降温至10℃时所得溶液均为饱和溶液,此时硝酸钾的溶解度最小,根据饱和溶液中溶质的质量分数=$\frac{溶解度}{溶解度+100g}×100%$可知,此时硝酸钾溶液中溶质的质量分数最小,故填:硝酸钾.
点评 本题难度不是很大,主要考查了固体溶解度表格所表示的意义,并能根据固体的溶解度表格解决相关的问题,从而培养学生分析问题、解决问题的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.下列属于纯净物的是( )
| A. | 铁锈 | B. | 乙醇 | C. | 加碘盐 | D. | 蛋壳 |
8.下列有关燃烧和灭火的说法中,不正确的是( )
| A. | 风助火威--为燃烧提供足够多的氧气 | |
| B. | 杯水车薪一水少了不能降低温度使温度低于可燃物的着火点 | |
| C. | 釜底袖薪一隔离可燃物可以灭火 | |
| D. | 水火不容--用水可以灭火,是因为降低了可燃物的着火点 |
18. 小明同学利用一瓶敞口放置已久的NaOH溶液进行了一些实验探究.
小明同学利用一瓶敞口放置已久的NaOH溶液进行了一些实验探究.
【提出问题】这瓶NaOH溶液变质程度如何呢?
【提出猜想】小明的猜想:NaOH溶液部分变质.
【实验探究】小明设计如下实验来验证自己的猜想,请根据表中内容填写小明实验时的现象:
【实验反思】下列物质①Ca(OH)2溶液、②Ba(NO3)2溶液、③BaCl2溶液,能替代小明实验中CaCl2溶液的是②③ (填序号).
【拓展应用】通过实际实验,确认这瓶放置已久的NaOH溶液部分变质.现从该瓶中取了100g 溶液,向其中逐滴加入11.1%的CaCl2溶液,产生沉淀质量与所加CaCl2溶液质量的关系如图所示.
(1)A点处所得溶液中溶质有NaCl、NaOH.
(2)求待测溶液中Na2CO3的质量分数.( 写出计算过程)
 小明同学利用一瓶敞口放置已久的NaOH溶液进行了一些实验探究.
小明同学利用一瓶敞口放置已久的NaOH溶液进行了一些实验探究.【提出问题】这瓶NaOH溶液变质程度如何呢?
【提出猜想】小明的猜想:NaOH溶液部分变质.
【实验探究】小明设计如下实验来验证自己的猜想,请根据表中内容填写小明实验时的现象:
| 实验步骤 | 实验现象 | 结论 |
| (1)取样,滴加足量的CaCl2溶液. | 产生白色沉淀. | NaOH溶液部分变质. |
| (2)过滤,向滤液中滴加几滴无色酚酞试液. | 无色酚酞变红色 |
【拓展应用】通过实际实验,确认这瓶放置已久的NaOH溶液部分变质.现从该瓶中取了100g 溶液,向其中逐滴加入11.1%的CaCl2溶液,产生沉淀质量与所加CaCl2溶液质量的关系如图所示.
(1)A点处所得溶液中溶质有NaCl、NaOH.
(2)求待测溶液中Na2CO3的质量分数.( 写出计算过程)
5. 我们学习过常见气体的实验室制法,知道了制取气体的一般思路和方法.
我们学习过常见气体的实验室制法,知道了制取气体的一般思路和方法.
(1)实验室制取气体时,确定发生装置需要考虑的两个因素有AC(填序号);
A.反应物的状态 B.气体的密度
C.反应的条件 D.气体的溶解性
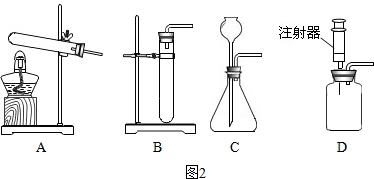
(2)某实验室的仪器柜里有如图1的仪器:写出图中标号①仪器的名称长颈漏斗.实验室用大理石和稀盐酸制备并收集一瓶干燥的二氧化碳时,不可能选择的仪器是②⑤(填序号);
(3)老师问:“如果实验室在没有大理石的情况下能否用碳酸钠粉末与稀盐酸来制取二氧化碳呢?”,大多数同学认为可以,反应的化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑.为了完成该实验,有四位同学组装了以下发生装置,你认为最合适的一套装置是D(填序号),该装置的最大优点是能控制反应速率.
(4)某实验小组还利用下图装置对实验室制取CO2的速率快慢进行了研究.他们实验时所用的试剂和使用的反应条件如下表所示:
实验小组同学设计的实验方案部分如下表,请根据表中信息帮助填写完整.
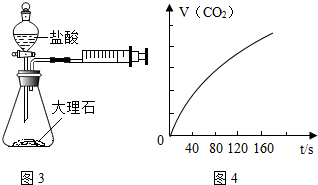 实验探究时,他们每次收集CO2气体均为40mL,则实验中他们还应记录的实验数据是收集40mL的CO2所需要的时间.图4是根据某次实验数据作出的CO2和时间变化的关系曲线,请分析在80秒以后,产生CO2逐渐减慢的可能原因:80秒后,盐酸反应了一部分,盐酸的浓度变低,反应速率变慢.
实验探究时,他们每次收集CO2气体均为40mL,则实验中他们还应记录的实验数据是收集40mL的CO2所需要的时间.图4是根据某次实验数据作出的CO2和时间变化的关系曲线,请分析在80秒以后,产生CO2逐渐减慢的可能原因:80秒后,盐酸反应了一部分,盐酸的浓度变低,反应速率变慢.
 我们学习过常见气体的实验室制法,知道了制取气体的一般思路和方法.
我们学习过常见气体的实验室制法,知道了制取气体的一般思路和方法.(1)实验室制取气体时,确定发生装置需要考虑的两个因素有AC(填序号);
A.反应物的状态 B.气体的密度
C.反应的条件 D.气体的溶解性
(2)某实验室的仪器柜里有如图1的仪器:写出图中标号①仪器的名称长颈漏斗.实验室用大理石和稀盐酸制备并收集一瓶干燥的二氧化碳时,不可能选择的仪器是②⑤(填序号);
(3)老师问:“如果实验室在没有大理石的情况下能否用碳酸钠粉末与稀盐酸来制取二氧化碳呢?”,大多数同学认为可以,反应的化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑.为了完成该实验,有四位同学组装了以下发生装置,你认为最合适的一套装置是D(填序号),该装置的最大优点是能控制反应速率.

(4)某实验小组还利用下图装置对实验室制取CO2的速率快慢进行了研究.他们实验时所用的试剂和使用的反应条件如下表所示:
| 盐酸 | 大理石 | 温度条件 |
| 5% | 细颗粒 | 20℃ |
| 10% | 粗颗粒 | 40℃ |
| 每次用量均20mL | 每次用量均5g |
| 实验编号 | 温度 | 大理石规格 | HCl浓度 | 探究目的 |
| ① | 20℃ | 粗颗粒 | 5% | (I)实验①和②探究浓度对反应快慢的影响; (II)实验②和④探究温度对反应快慢的影响; (III)实验①和③③探究大理石粗、细对反应快慢的影响. |
| ② | 20℃ | 粗颗粒 | 10% | |
| ③ | 20℃ | 细颗粒 | 5% | |
| ④ | 40℃ | 粗颗粒 | 10% |
 实验探究时,他们每次收集CO2气体均为40mL,则实验中他们还应记录的实验数据是收集40mL的CO2所需要的时间.图4是根据某次实验数据作出的CO2和时间变化的关系曲线,请分析在80秒以后,产生CO2逐渐减慢的可能原因:80秒后,盐酸反应了一部分,盐酸的浓度变低,反应速率变慢.
实验探究时,他们每次收集CO2气体均为40mL,则实验中他们还应记录的实验数据是收集40mL的CO2所需要的时间.图4是根据某次实验数据作出的CO2和时间变化的关系曲线,请分析在80秒以后,产生CO2逐渐减慢的可能原因:80秒后,盐酸反应了一部分,盐酸的浓度变低,反应速率变慢.
2.用数轴可以比较直观地表示某些科学知识.下列用数轴表示的科学知识,错误的是( )
| A. |  部分金属活动性顺序 | B. |  生物的分类等级 | ||
| C. |  部分元素的原子序数 | D. |  空气中部分成分的体积分数 |

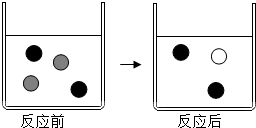 向AgNO3溶液中加入过量的铜粉充分反应,回答下列问题:
向AgNO3溶液中加入过量的铜粉充分反应,回答下列问题: Ag+、
Ag+、 Cu2+.
Cu2+. 如图是A、B固体物质的溶解度曲线
如图是A、B固体物质的溶解度曲线