题目内容
16.已知木炭还原氧化铜实验中发生的主要反应:C+2CuO$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑,某化学兴趣小组对该实验红色固体产物的成份(假设反应物已完全反应)作如下探究:探究一:检验红色固体产物的成份
【查阅资料】
Ⅰ.木炭还原氧化铜除生成铜外还可能生成氧化亚铜(Cu2O);
Ⅱ.Cu和Cu2O均为不溶于水的红色固体;Ⅲ.Cu2O+H2SO4=CuSO4+Cu+H2O
【提出问题】该实验的红色固体产物中含有什么物质?
【猜想与假设】
假设1:红色固体只含Cu;
假设2:红色固体只含Cu2O;
假设3:红色固体Cu、Cu2O的混合物(请补充完成假设3).
【实验探究】(填写表中空格)
| 实验操作 | 实验现象 | 实验结论 |
| 取少量红色固体加入到足量稀硫酸溶液中 | 若无明显现象 | 假设1成立 |
| 若固体部分(选填“全部”或“部分”)溶解,溶液由无色变蓝色 | 假设2和假设3均成立 |
该化学兴趣小组经交流讨论后,设计了如下两方案:
【方案一】称取5.00g红色固体加入到足量稀硫酸溶液中使其充分反应后,操作A、洗涤、干燥,称量得红色固体质量为4.20g.
(1)操作A的名称是过滤,在实验室中完成操作A的玻璃仪器有玻璃棒、烧杯和漏斗;
(2)检验反应后剩余红色固体是否洗涤干净的方法是:取少量最后一次洗涤液,加入氢氧化钠溶液,如果观察到现象:无蓝色沉淀生成,说明已洗涤干净.
(3)通过计算,假设3成立,红色固体产物中Cu2O的含量为1.44g;
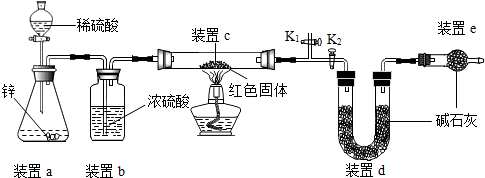
【方案二】称取5.00g的红色固体,用如图所示装置进行实验(固定装置略去,碱石灰为氧化钙和氢氧化钠的混合物),通过测定反应前后装置d的质量达到实验目的.
(1)装置a中用稀硫酸而不用稀盐酸,原因是盐酸挥发出氯化氢气体,与d中的物质反应,影响测定结果;
(2)装置b的作用是干燥氢气,若不加装置b,实验结果会偏大(“偏大”或“偏小”);
(3)装置c中涉及的反应化学方程式Cu2O+H2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+H2O;
(4)装置e的作用是防止空气中CO2及H2O对装置d的测量造成误差,若不加装置e,实验结果会偏大(“偏大”或“偏小”);
(5)点燃酒精灯前涉及的部分操作如下,
①连接仪器;②检查装置的气密性;
③关闭K2,打开K1,通氢气一段时间以赶尽装置内原有的空气,其目的是:a.防止空气中的H2O和CO2进入装置d干扰测定;b.防氢气不纯,发生爆炸,检验空气是否赶尽的方法是:在K1处用小试管收集气体,进行点燃;④打开K2,关闭K1
(6)经测定反应前后装置d的质量分别为100.00g、100.18g,计算产物中Cu2O的含量(写出计算过程,最后结果保留小数点后1位);
【交流与反思】
(1)在方案一实验测定中,若测定结果偏大,则下列可能的原因有①、②.(填序号)
①反应后剩余红色固体未洗涤干净 ②洗涤后未完全干燥
③干燥方法采用的是在空气中加热烘干 ④称量剩余红色固体时,有部分固体洒落到实验台上
(2)方案二中利用同样的装置,还可通过测定反应前后装置c(填“a”、“b”或“c”)的质量达到实验目的.
分析 探究一:【猜想与假设】因为Cu和Cu2O均为不溶于水的红色固体,则根据假设1、2,推测假设3;
【设计实验】如果暗红色固体中含有Cu2O,加入稀硫酸时,Cu2O和稀硫酸反应生成硫酸铜,硫酸铜溶液是蓝色的;
探究二:
【方案一】(1)考虑操作A是过滤,掌握在实验室中完成过滤的玻璃仪器;
(2)考虑氢氧化钠与硫酸铜溶液反应生成蓝色沉淀;
(3)根据Cu2O+H2SO4=CuSO4+Cu+H2O,通过计算,如果假设3成立,可计算红色固体产物中Cu2O的含量;
【方案二】
(1)盐酸易挥发,容易挥发出氯化氢气体;
(2)考虑浓硫酸的吸水干燥作用;
(3)装置c中涉及的反应为:氢气与Cu2O生成铜与水;
(4)空气中含有水蒸气和二氧化碳,能够被碱石灰吸收;
(5)正确的顺序是:先连接仪器,检查装置的气密性,再关闭K2,打开K1,通氢气一段时间,把装置中的水蒸气和二氧化碳排出,再打开K2,关闭K1,点燃酒精灯;
(6)根据化学方程式化和质量守恒定律,计算产物中Cu2O的含量;
【交流与反思】
(1)根据在方案一的测定实验,考虑测定结果偏大的可能的原因;
(2)通过测定反应前后c装置的质量也可以达到实验目的.
解答 解:探究一:
【猜想与假设】因为Cu和Cu2O均为不溶于水的红色固体,则根据假设1、2,推测假设3为红色固体Cu、Cu2O的混合物;
【设计实验】取少量暗红色固体,加入稀硫酸,如果观察到固体部分溶解,溶液变成蓝色,即Cu2O+H2SO4=CuSO4+Cu+H2O,说明暗红色固体含有Cu2O.
探究二:
【方案一】称取5.00g红色固体加入到足量稀硫酸溶液中使其充分反应后,操作A、洗涤、干燥,称量得红色固体质量为4.20g.故:
(1)操作A的名称是 过滤,在实验室中完成操作A的玻璃仪器有玻璃棒、烧杯和漏斗;
(2)检验反应后剩余红色固体是否洗涤干净的方法是:取少量最后一次洗涤液,加入氢氧化钠溶液,如果观察到现象:无蓝色沉淀生成,说明已洗涤干净.
(3)设红色固体产物中Cu2O的质量为x.
根据Cu2O+H2SO4=CuSO4+Cu+H2O 质量差
144 64 80
x 5.00g-4.20g=0.8g
则$\frac{144}{80}=\frac{x}{0.8g}$,解得x=1.44g
通过计算,假设3成立,红色固体产物中Cu2O的含量为1.44g
【方案二】
(1)装置a中用稀硫酸而不用稀盐酸,原因是盐酸易挥发,挥发出的氯化氢能被碱石灰吸收,影响测定结果.
(2)装置b的作用是 干燥氢气,若不加装置b,实验结果会偏大;
(3)装置c中涉及的反应化学方程式Cu2O+H2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+H2O;
(4)若不加装置e,实验结果会偏高,原因是d中的碱石灰能够吸收空气中的水和二氧化碳,从而使测定的水的质量偏高,会导致计算的Cu2O的质量偏高,从而导致实验结果会偏大;
(5)点燃酒精灯前涉及的部分操作如下,①连接仪器;②检查装置的气密性;③关闭K2,打开K1,通氢气一段时间以赶尽装置内原有的空气,其目的是:a.防止空气中的H2O和CO2进入装置d干扰测定;b.防氢气不纯,发生爆炸,检验空气是否赶尽的方法是:在K1处用小试管收集气体,进行点燃实验;④打开K2,关闭K1;
(6)经测定反应前后装置d的质量分别为100.00g、100.18g,则根据质量守恒定律,生成水的质量为100.18g-100.00g=0.18g,则设产物中Cu2O的含量为x.
Cu2O+H2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+H2O
144 18
x 0.18g
则$\frac{144}{18}=\frac{x}{0.18g}$,解得x=1.44g
答:产物中Cu2O的含量为1.44g.
【交流与反思】
(1)在方案一实验测定中,若测定结果偏大,则下列可能的原因有:①反应后剩余红色固体未洗涤干净;②洗涤后未完全干燥,而称量剩余红色固体时,有部分固体洒落到实验台上,结果偏小,故选①、②.
(2)还可通过测定反应前后装置c的质量达到实验目的,反应前后装置c的质量差即为Cu2O中氧元素的质量,根据氧元素的质量可以计算Cu2O的质量,进一步可以计算产物中Cu2O的含量.故填:c.
故答案为:
【猜想与假设】红色固体Cu、Cu2O的混合物.
【实验探究】(填写表中空格):部分
探究二:【方案一】(1)过滤,漏斗;(2)氢氧化钠,无蓝色沉淀生成.(3)1.44g;
【方案二】(1)盐酸挥发出氯化氢气体,与d中的物质反应,影响测定结果;
(2)干燥氢气,偏大;(3)Cu2O+H2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+H2O;
(4)防止空气中CO2及H2O对装置d的测量造成误差,偏大;
(5)②检查装置的气密性;③氢气不纯,发生爆炸,点燃;(6)1.44g
【交流与反思】(1)①、②;(2)c
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 如图是甲、乙、丙三种物质(均不含结晶水)的溶解度曲线.现有t2℃时甲、乙、丙三种物质的饱和溶液(无固体存在). 下列说法正确的是( )
如图是甲、乙、丙三种物质(均不含结晶水)的溶解度曲线.现有t2℃时甲、乙、丙三种物质的饱和溶液(无固体存在). 下列说法正确的是( )| A. | 三种物质溶解度大小依次为:乙>丙>甲 | |
| B. | 将温度由t2℃降到t1℃时,析出甲的质量比乙多 | |
| C. | 若甲中含有少量杂质乙,可采用降温结晶的方法进行提纯 | |
| D. | 将温度由t2℃降到t1℃,所得溶液中溶质的质量分数由大到小的顺序为:乙>丙=甲 |
| A. |  铁丝在氧气中燃烧 | B. |  检验CO2 | ||
| C. |  测溶液PH值 | D. |  过滤 |
| A. | 一定不存在Ba2+ | B. | 无法确定CO32-是否存在 | ||
| C. | Na+一定存在 | D. | 一定不存在Cl- |
(1)第2次实验中金属镁与盐酸恰好完全反应.
(2)第4次实验中氢气的质量为0.7g
(3)计算盐酸的质量分数.
| 编号 | Mg(g) | 盐酸(g) | 生成氢气(g) |
| 1 | 2.4 | 100 | 0.2 |
| 2 | 4.8 | 100 | 0.4 |
| 3 | 7.2 | 100 | 0.4 |
| 4 | 8.4 | 200 | ? |
| A. |  研究物体运动形式 | B. |  制作丰富的食品 | ||
| C. |  研制新的药物 | D. |  合成新物质 |

