题目内容
11.今有一混合物的水溶液,只可能含有以下离子中的若干种:Na+、NH4+、Ba2+、Cl-、CO32-、SO42-.现取两份200mL溶液进行如下实验:①第一份加足量NaOH溶液,加热,收集到气体0.17g;②第二份加足量BaCl2溶液后,得干燥沉淀2.33g,经足量盐酸洗涤、干燥后,沉淀质量不变.根据上述实验,以下推测正确的是( )| A. | 一定不存在Ba2+ | B. | 无法确定CO32-是否存在 | ||
| C. | Na+一定存在 | D. | 一定不存在Cl- |
分析 根据题目给出的信息:第一份加足量NaOH溶液,加热,收集到气体0.17g,那么该气体是氨气,则一定有NH4+离子;第二份加足量BaCl2溶液后,得干燥沉淀质量为2.33g,经足量盐酸洗涤、干燥后,沉淀质量不变,因此一定有SO42-;一定没有CO32-,因为Ba2+与SO42-不能共存,因此一定没有Ba2+;通过摩尔数计算阴离子总数大于阳离子总数,所以一定含钠离子,Cl-可能有,也可能没有.
解答 解:①能与足量NaOH溶液共热产生气体的物质应为铵盐,因此溶液中应含有铵根离子;故一定存在NH4+;收集到气体0.17g,即0.01mol,根据铵根和氢氧根1:1反应得到氨气可知铵根的物质的量为0.01mol;
②在溶液可能存在的六种离子中,能与氯化钡溶液反应形成的沉淀只有碳酸钡和硫酸钡,因此沉淀有三种情况:可能是碳酸钡;可能是硫酸钡;可能是既有碳酸钡又有硫酸钡;其中硫酸钡不溶于酸也不能与酸反应;而碳酸钡与酸能反应而沉淀质量减少;根据(得干燥沉淀2.33 g,经足量盐酸洗涤、干燥后,沉淀质量为不变)故沉淀为:只有硫酸钡,没有碳酸钡;
确定原溶液中存在SO42-;因为Ba2+与SO42-在溶液中不能共存,确定原溶液中一定不存在Ba2+;
Cl-对①②的现象,没有影响,因此可能有,也可能没有;
第二份得到沉淀质量为2.33g,根据硫酸钡的质量可求硫酸根的物质的量为0.01mol;
则铵根带有的正电荷的物质的量为0.01mol×1=0.01mol,硫酸根带有的负电荷的物质的量为0.01mol×2=0.02mol,发现负电荷多,故还应该含有带正电荷的离子,则还含有Na+;
故原溶液中一定存在NH4+、SO42-、Na+,一定不存在Ba2+、CO32-,可能存在Cl-;
故选:AC.
点评 本考点考查的是物质的鉴别,要根据题目给出的信息,由现象得出正确的结论.鉴别题是初中阶段的一个重点,可根据不同的性质来鉴别,因此要掌握好常见物质和酸碱盐的性质,如硫酸钡、氯化银为既不溶于水也不能溶于酸且不能与酸反应的两种白色沉淀.

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案| A. | 117g | B. | 46g | C. | 80g | D. | 106g |
| A. | 水的天然循环中水分子和水分子的能量都不变 | |
| B. | 二氧化碳的循环与大自然的森林绿化面积无关 | |
| C. | 自然界中的氧循环主要是通过化学变化实现的 | |
| D. | 自然界中的碳循环主要是通过物理变化实现的 |
| 第一次 | 第二次 | 第三次 | |
| O2质量(g) | 3 | 4 | 6 |
| SO2质量(g) | 6 |
(2)在表中填写第三次实验生成二氧化硫的质量.
 为测定锌铜合金中锌的含量,取该合金放入盛有稀硫酸的锥形瓶中(如图),发生反应.多次实验后,取平均值所得数据如下表:
为测定锌铜合金中锌的含量,取该合金放入盛有稀硫酸的锥形瓶中(如图),发生反应.多次实验后,取平均值所得数据如下表:| 反应前 | 充分反应后装置及反应剩余物质质量 | |
| 装置和足量的稀硫酸质量 | 锌铜合金质量 | |
| 342.10g | 16.00g | 357.70g |
(1)生成氢气的质量为0.4g.
(2)该合金中锌的质量分数.
探究一:检验红色固体产物的成份
【查阅资料】
Ⅰ.木炭还原氧化铜除生成铜外还可能生成氧化亚铜(Cu2O);
Ⅱ.Cu和Cu2O均为不溶于水的红色固体;Ⅲ.Cu2O+H2SO4=CuSO4+Cu+H2O
【提出问题】该实验的红色固体产物中含有什么物质?
【猜想与假设】
假设1:红色固体只含Cu;
假设2:红色固体只含Cu2O;
假设3:红色固体Cu、Cu2O的混合物(请补充完成假设3).
【实验探究】(填写表中空格)
| 实验操作 | 实验现象 | 实验结论 |
| 取少量红色固体加入到足量稀硫酸溶液中 | 若无明显现象 | 假设1成立 |
| 若固体部分(选填“全部”或“部分”)溶解,溶液由无色变蓝色 | 假设2和假设3均成立 |
该化学兴趣小组经交流讨论后,设计了如下两方案:
【方案一】称取5.00g红色固体加入到足量稀硫酸溶液中使其充分反应后,操作A、洗涤、干燥,称量得红色固体质量为4.20g.
(1)操作A的名称是过滤,在实验室中完成操作A的玻璃仪器有玻璃棒、烧杯和漏斗;
(2)检验反应后剩余红色固体是否洗涤干净的方法是:取少量最后一次洗涤液,加入氢氧化钠溶液,如果观察到现象:无蓝色沉淀生成,说明已洗涤干净.
(3)通过计算,假设3成立,红色固体产物中Cu2O的含量为1.44g;
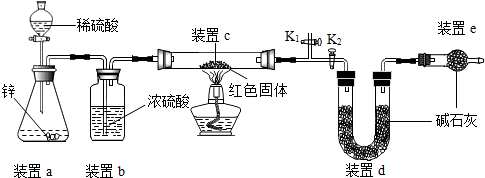
【方案二】称取5.00g的红色固体,用如图所示装置进行实验(固定装置略去,碱石灰为氧化钙和氢氧化钠的混合物),通过测定反应前后装置d的质量达到实验目的.
(1)装置a中用稀硫酸而不用稀盐酸,原因是盐酸挥发出氯化氢气体,与d中的物质反应,影响测定结果;
(2)装置b的作用是干燥氢气,若不加装置b,实验结果会偏大(“偏大”或“偏小”);
(3)装置c中涉及的反应化学方程式Cu2O+H2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+H2O;
(4)装置e的作用是防止空气中CO2及H2O对装置d的测量造成误差,若不加装置e,实验结果会偏大(“偏大”或“偏小”);
(5)点燃酒精灯前涉及的部分操作如下,
①连接仪器;②检查装置的气密性;
③关闭K2,打开K1,通氢气一段时间以赶尽装置内原有的空气,其目的是:a.防止空气中的H2O和CO2进入装置d干扰测定;b.防氢气不纯,发生爆炸,检验空气是否赶尽的方法是:在K1处用小试管收集气体,进行点燃;④打开K2,关闭K1
(6)经测定反应前后装置d的质量分别为100.00g、100.18g,计算产物中Cu2O的含量(写出计算过程,最后结果保留小数点后1位);
【交流与反思】
(1)在方案一实验测定中,若测定结果偏大,则下列可能的原因有①、②.(填序号)
①反应后剩余红色固体未洗涤干净 ②洗涤后未完全干燥
③干燥方法采用的是在空气中加热烘干 ④称量剩余红色固体时,有部分固体洒落到实验台上
(2)方案二中利用同样的装置,还可通过测定反应前后装置c(填“a”、“b”或“c”)的质量达到实验目的.

 如图是a、b、c三种物质(均不含结晶水)的溶解度曲线,请填空:
如图是a、b、c三种物质(均不含结晶水)的溶解度曲线,请填空: