题目内容
5.“对比实验”是化学学习中行之有效的思维方法.某化学学习小组的同学在学完相关的化学知识后,走进实验室做了如下实验,请你参与并回答下列问题.A.燃烧的条件 B.铁钉生锈的条件 C.证明CO2与NaOH反应 D.分子运动的现象
(1)通过实验A,可以说明燃烧的条件之一是达到燃烧所需的最低温度(或达到着火点).
(2)对于实验B,一段时间后观察到试管①中的铁钉明显锈蚀,由此得出:铁生锈的主要条件是铁与水和氧气(或空气) 直接接触.欲除去铁锈可用稀盐酸(或稀硫酸)洗的方法,
(3)实验C是利用体积相同并充满CO2的软塑料瓶、等量的水(瓶①)和NaOH溶液(瓶②)进行实验,根据塑料瓶变瘪的程度证明CO2 与NaOH溶液中的溶质确实发生了反应,这一反应的化学方程式为CO2+2NaOH=Na2CO3+H2O.
(4)实验D的烧杯②中呈现的现象能说明分子是不断运动的.当烧杯①中液体是浓氨水时烧杯②中的酚酞溶液由无色变为红色;当烧杯①中液体换成浓盐酸,且烧杯②中液体换成滴有酚酞的NaOH溶液时,一段时间后,溶液颜色的变化是红色逐渐变成无色.

分析 (1)根据燃烧的条件进行解答;
(2)根据铁生锈的主要条件是铁与水和空气直接接触以及除去铁锈可用盐酸清洗方法进行解答;
(3)根据二氧化碳和NaOH溶液反应生成碳酸钠和水进行解答;
(4)根据浓盐酸具有挥发性分析蒸馏水的酸碱性进行解答.
解答 解:
(1)燃烧的条件:物质具有可燃性、与氧气接触、温度达到可燃物的着火点,实验A中滤纸碎片和乒乓球碎片都与氧气接触,在加热过程中,利用铜片的导热性,在中间加热,能够提供均匀的热量,由于乒乓球碎片的着火点较低,首先燃烧起来,说明燃烧需要温度达到可燃物的着火点;
(2)对于实验B,一段时间观察试管①中的铁钉明显锈蚀,①试管中即提供了空气,也提供了水,由此得出:铁生锈的主要条件是铁与水和空气直接接触;铁锈的主要成分是氧化铁,所以欲除去铁锈可用盐酸洗方法,铁制品除锈时不能长时间浸在酸溶液中,因为酸也和金属反应;
(3)二氧化碳和NaOH溶液反应生成碳酸钠和水,故反应的化学方程式为2NaOH+CO2═Na2CO3+H2O;
(4)实验D的烧杯②中呈现的现象能说明分子是不断运动的.当烧杯①中液体时浓氨水时,浓氨水具有挥发性,挥发出的氨气溶于水显碱性,所以烧杯②中的酚酞溶液由无色变为红色;
答案:
(1)达到燃烧所需的最低温度(或达到着火点)
(2)氧气(或空气) 稀盐酸(或稀硫酸)
(3)CO2+2NaOH=Na2CO3+H2O
(4)红 红色逐渐变成无色
点评 此题是一道综合性的实验设计题,解题的关键是掌握燃烧的条件、铁生锈的条件、二氧化碳的性质、微粒的性质并进行知识的大胆迁移,只有这样才能顺利解题.

练习册系列答案
相关题目
16.已知木炭还原氧化铜实验中发生的主要反应:C+2CuO$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑,某化学兴趣小组对该实验红色固体产物的成份(假设反应物已完全反应)作如下探究:
探究一:检验红色固体产物的成份
【查阅资料】
Ⅰ.木炭还原氧化铜除生成铜外还可能生成氧化亚铜(Cu2O);
Ⅱ.Cu和Cu2O均为不溶于水的红色固体;Ⅲ.Cu2O+H2SO4=CuSO4+Cu+H2O
【提出问题】该实验的红色固体产物中含有什么物质?
【猜想与假设】
假设1:红色固体只含Cu;
假设2:红色固体只含Cu2O;
假设3:红色固体Cu、Cu2O的混合物(请补充完成假设3).
【实验探究】(填写表中空格)
探究二:测定该实验红色固体产物中Cu2O的含量
该化学兴趣小组经交流讨论后,设计了如下两方案:
【方案一】称取5.00g红色固体加入到足量稀硫酸溶液中使其充分反应后,操作A、洗涤、干燥,称量得红色固体质量为4.20g.
(1)操作A的名称是过滤,在实验室中完成操作A的玻璃仪器有玻璃棒、烧杯和漏斗;
(2)检验反应后剩余红色固体是否洗涤干净的方法是:取少量最后一次洗涤液,加入氢氧化钠溶液,如果观察到现象:无蓝色沉淀生成,说明已洗涤干净.
(3)通过计算,假设3成立,红色固体产物中Cu2O的含量为1.44g;
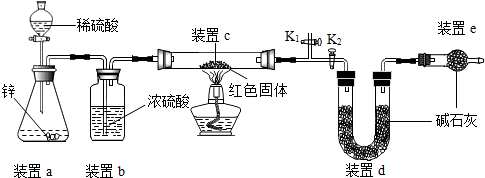
【方案二】称取5.00g的红色固体,用如图所示装置进行实验(固定装置略去,碱石灰为氧化钙和氢氧化钠的混合物),通过测定反应前后装置d的质量达到实验目的.
(1)装置a中用稀硫酸而不用稀盐酸,原因是盐酸挥发出氯化氢气体,与d中的物质反应,影响测定结果;
(2)装置b的作用是干燥氢气,若不加装置b,实验结果会偏大(“偏大”或“偏小”);
(3)装置c中涉及的反应化学方程式Cu2O+H2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+H2O;
(4)装置e的作用是防止空气中CO2及H2O对装置d的测量造成误差,若不加装置e,实验结果会偏大(“偏大”或“偏小”);
(5)点燃酒精灯前涉及的部分操作如下,
①连接仪器;②检查装置的气密性;
③关闭K2,打开K1,通氢气一段时间以赶尽装置内原有的空气,其目的是:a.防止空气中的H2O和CO2进入装置d干扰测定;b.防氢气不纯,发生爆炸,检验空气是否赶尽的方法是:在K1处用小试管收集气体,进行点燃;④打开K2,关闭K1
(6)经测定反应前后装置d的质量分别为100.00g、100.18g,计算产物中Cu2O的含量(写出计算过程,最后结果保留小数点后1位);
【交流与反思】
(1)在方案一实验测定中,若测定结果偏大,则下列可能的原因有①、②.(填序号)
①反应后剩余红色固体未洗涤干净 ②洗涤后未完全干燥
③干燥方法采用的是在空气中加热烘干 ④称量剩余红色固体时,有部分固体洒落到实验台上
(2)方案二中利用同样的装置,还可通过测定反应前后装置c(填“a”、“b”或“c”)的质量达到实验目的.
探究一:检验红色固体产物的成份
【查阅资料】
Ⅰ.木炭还原氧化铜除生成铜外还可能生成氧化亚铜(Cu2O);
Ⅱ.Cu和Cu2O均为不溶于水的红色固体;Ⅲ.Cu2O+H2SO4=CuSO4+Cu+H2O
【提出问题】该实验的红色固体产物中含有什么物质?
【猜想与假设】
假设1:红色固体只含Cu;
假设2:红色固体只含Cu2O;
假设3:红色固体Cu、Cu2O的混合物(请补充完成假设3).
【实验探究】(填写表中空格)
| 实验操作 | 实验现象 | 实验结论 |
| 取少量红色固体加入到足量稀硫酸溶液中 | 若无明显现象 | 假设1成立 |
| 若固体部分(选填“全部”或“部分”)溶解,溶液由无色变蓝色 | 假设2和假设3均成立 |
该化学兴趣小组经交流讨论后,设计了如下两方案:
【方案一】称取5.00g红色固体加入到足量稀硫酸溶液中使其充分反应后,操作A、洗涤、干燥,称量得红色固体质量为4.20g.
(1)操作A的名称是过滤,在实验室中完成操作A的玻璃仪器有玻璃棒、烧杯和漏斗;
(2)检验反应后剩余红色固体是否洗涤干净的方法是:取少量最后一次洗涤液,加入氢氧化钠溶液,如果观察到现象:无蓝色沉淀生成,说明已洗涤干净.
(3)通过计算,假设3成立,红色固体产物中Cu2O的含量为1.44g;
【方案二】称取5.00g的红色固体,用如图所示装置进行实验(固定装置略去,碱石灰为氧化钙和氢氧化钠的混合物),通过测定反应前后装置d的质量达到实验目的.
(1)装置a中用稀硫酸而不用稀盐酸,原因是盐酸挥发出氯化氢气体,与d中的物质反应,影响测定结果;
(2)装置b的作用是干燥氢气,若不加装置b,实验结果会偏大(“偏大”或“偏小”);
(3)装置c中涉及的反应化学方程式Cu2O+H2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+H2O;
(4)装置e的作用是防止空气中CO2及H2O对装置d的测量造成误差,若不加装置e,实验结果会偏大(“偏大”或“偏小”);
(5)点燃酒精灯前涉及的部分操作如下,
①连接仪器;②检查装置的气密性;
③关闭K2,打开K1,通氢气一段时间以赶尽装置内原有的空气,其目的是:a.防止空气中的H2O和CO2进入装置d干扰测定;b.防氢气不纯,发生爆炸,检验空气是否赶尽的方法是:在K1处用小试管收集气体,进行点燃;④打开K2,关闭K1
(6)经测定反应前后装置d的质量分别为100.00g、100.18g,计算产物中Cu2O的含量(写出计算过程,最后结果保留小数点后1位);
【交流与反思】
(1)在方案一实验测定中,若测定结果偏大,则下列可能的原因有①、②.(填序号)
①反应后剩余红色固体未洗涤干净 ②洗涤后未完全干燥
③干燥方法采用的是在空气中加热烘干 ④称量剩余红色固体时,有部分固体洒落到实验台上
(2)方案二中利用同样的装置,还可通过测定反应前后装置c(填“a”、“b”或“c”)的质量达到实验目的.

13.下列对一些事实的解释中,不合理的是( )
| 事实 | 解释 | |
| A | 春天,丁香花花香四溢 | 分子在不断运动 |
| B | H2O和H2O2的性质不同 | 组成元素相同,分子构成不同 |
| C | 氧气和氢气在点燃的条件下可以生成水 | 化学反应实质是分子的再分和原子的重组 |
| D | 体温计中的汞随着温度的升高体积变大 | 分子间的间隔随温度变化而变化 |
| A. | A | B. | B | C. | C | D. | D |
10.下列物质的用途与性质不对应的是( )
| A. | 食品包装中充氦气以防腐-常温下氦气的化学性质不活泼 | |
| B. | 一氧化碳用于冶炼金属-一氧化碳难溶于水 | |
| C. | 稀有气体能制成多种用途的电光源-稀有气体在通电时发出不同颜色的光 | |
| D. | 干冰可用做制冷剂-干冰升华吸热 |
14.下列说法正确的是( )
| A. | 原子核是由质子和中子构成的,所以所有原子的原子核都含有质子和中子 | |
| B. | 常见的铁合金有生铁和钢,其中钢的含碳量比生铁的高 | |
| C. | 洗涤剂能去除餐具上的油污,因为洗涤剂具有乳化作用 | |
| D. | 喝了汽水会打嗝,因为压强减小,气体的溶解度减小 |
15.下列有关燃烧与灭火的说法不正确的是( )
| A. | 木柴架空了能够燃烧更旺--与氧气充分接触 | |
| B. | 森林灭火时,建立隔离带--隔离可燃物 | |
| C. | 水能灭火--水蒸发吸热能降低可燃物的着火点 | |
| D. | 用灯帽盖灭酒精灯--隔绝氧气 |


