题目内容
1.某课外活动小组的同学,分别用一定量的金属镁与盐酸反应,所做的四次实验结果如下表,请你根据表中的数据,回答下列问题:(1)第2次实验中金属镁与盐酸恰好完全反应.
(2)第4次实验中氢气的质量为0.7g
(3)计算盐酸的质量分数.
| 编号 | Mg(g) | 盐酸(g) | 生成氢气(g) |
| 1 | 2.4 | 100 | 0.2 |
| 2 | 4.8 | 100 | 0.4 |
| 3 | 7.2 | 100 | 0.4 |
| 4 | 8.4 | 200 | ? |
分析 根据实验数据可知,第二次、三次实验中生成的氢气的质量为0.4g,而第一次中只生成了0.2g氢气.说明第一次中盐酸有剩余,而第二次、三次生成的氢气一样多,但是第三次金属的质量多,所以金属有剩余,即100g盐酸已经全部反应,所以200g酸由第二次看出可反应9.6g金属,所以这里酸没有过量,最后算得结果我是0.7g,利用氢气的质量求出氯化氢的质量,进而求出盐酸的质量分数即可.
解答 解:(1)根据实验数据可知,第二次、三次实验中生成的氢气的质量为0.4g,而第一次中只生成了0.2g氢气.说明第一次中盐酸有剩余,而第二次、三次生成的氢气一样多,但是第三次金属的质量多,所以金属有剩余,即第2次实验中金属镁与盐酸恰好完全反应;故填:2;
(2)200g酸由第二次看出可反应9.6g金属,所以这里酸没有过量,最后算得结果我是0.7g,即8.4g金属已经全部反应,所以第4次实验中氢气的质量仍为0.7g;故填:0.7;
(3)设100g稀盐酸中氯化氢的质量为x.
Mg+2HCl=MgCl2+H2↑
73 2
x 0.4g
$\frac{73}{x}=\frac{2}{0.4g}$
x=14.6g
盐酸的质量分数=$\frac{14.6g}{100g}×100%$=14.6%
答:盐酸中溶质的质量分数为14.6%.
点评 此题是一道图表数据分析综合题,解题的关键是弄明白表格中数据的意义,进而判断出反应时的物质的质量情况,该题综合性较强,难度较大.

练习册系列答案
相关题目
11.下列叙述正确的是( )
| A. | 对人体健康而言,铅、镉、汞等是有害元素 | |
| B. | 钙、铁、锌都是人体必需的微量元素 | |
| C. | 人体缺乏维生素A会引起坏血病 | |
| D. | 蛋白质、淀粉、甲烷都是有机高分子化合物 |
9.下列物质中富含蛋白质的有( )
| A. |  米饭和馒头 | B. |  大豆油和花生 | C. |  瘦肉和鸡蛋 | D. |  蔬菜和水果 |
16.已知木炭还原氧化铜实验中发生的主要反应:C+2CuO$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑,某化学兴趣小组对该实验红色固体产物的成份(假设反应物已完全反应)作如下探究:
探究一:检验红色固体产物的成份
【查阅资料】
Ⅰ.木炭还原氧化铜除生成铜外还可能生成氧化亚铜(Cu2O);
Ⅱ.Cu和Cu2O均为不溶于水的红色固体;Ⅲ.Cu2O+H2SO4=CuSO4+Cu+H2O
【提出问题】该实验的红色固体产物中含有什么物质?
【猜想与假设】
假设1:红色固体只含Cu;
假设2:红色固体只含Cu2O;
假设3:红色固体Cu、Cu2O的混合物(请补充完成假设3).
【实验探究】(填写表中空格)
探究二:测定该实验红色固体产物中Cu2O的含量
该化学兴趣小组经交流讨论后,设计了如下两方案:
【方案一】称取5.00g红色固体加入到足量稀硫酸溶液中使其充分反应后,操作A、洗涤、干燥,称量得红色固体质量为4.20g.
(1)操作A的名称是过滤,在实验室中完成操作A的玻璃仪器有玻璃棒、烧杯和漏斗;
(2)检验反应后剩余红色固体是否洗涤干净的方法是:取少量最后一次洗涤液,加入氢氧化钠溶液,如果观察到现象:无蓝色沉淀生成,说明已洗涤干净.
(3)通过计算,假设3成立,红色固体产物中Cu2O的含量为1.44g;
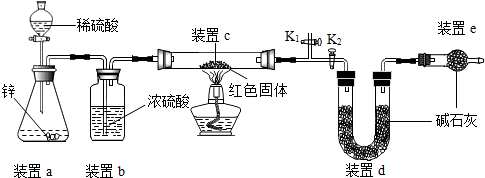
【方案二】称取5.00g的红色固体,用如图所示装置进行实验(固定装置略去,碱石灰为氧化钙和氢氧化钠的混合物),通过测定反应前后装置d的质量达到实验目的.
(1)装置a中用稀硫酸而不用稀盐酸,原因是盐酸挥发出氯化氢气体,与d中的物质反应,影响测定结果;
(2)装置b的作用是干燥氢气,若不加装置b,实验结果会偏大(“偏大”或“偏小”);
(3)装置c中涉及的反应化学方程式Cu2O+H2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+H2O;
(4)装置e的作用是防止空气中CO2及H2O对装置d的测量造成误差,若不加装置e,实验结果会偏大(“偏大”或“偏小”);
(5)点燃酒精灯前涉及的部分操作如下,
①连接仪器;②检查装置的气密性;
③关闭K2,打开K1,通氢气一段时间以赶尽装置内原有的空气,其目的是:a.防止空气中的H2O和CO2进入装置d干扰测定;b.防氢气不纯,发生爆炸,检验空气是否赶尽的方法是:在K1处用小试管收集气体,进行点燃;④打开K2,关闭K1
(6)经测定反应前后装置d的质量分别为100.00g、100.18g,计算产物中Cu2O的含量(写出计算过程,最后结果保留小数点后1位);
【交流与反思】
(1)在方案一实验测定中,若测定结果偏大,则下列可能的原因有①、②.(填序号)
①反应后剩余红色固体未洗涤干净 ②洗涤后未完全干燥
③干燥方法采用的是在空气中加热烘干 ④称量剩余红色固体时,有部分固体洒落到实验台上
(2)方案二中利用同样的装置,还可通过测定反应前后装置c(填“a”、“b”或“c”)的质量达到实验目的.
探究一:检验红色固体产物的成份
【查阅资料】
Ⅰ.木炭还原氧化铜除生成铜外还可能生成氧化亚铜(Cu2O);
Ⅱ.Cu和Cu2O均为不溶于水的红色固体;Ⅲ.Cu2O+H2SO4=CuSO4+Cu+H2O
【提出问题】该实验的红色固体产物中含有什么物质?
【猜想与假设】
假设1:红色固体只含Cu;
假设2:红色固体只含Cu2O;
假设3:红色固体Cu、Cu2O的混合物(请补充完成假设3).
【实验探究】(填写表中空格)
| 实验操作 | 实验现象 | 实验结论 |
| 取少量红色固体加入到足量稀硫酸溶液中 | 若无明显现象 | 假设1成立 |
| 若固体部分(选填“全部”或“部分”)溶解,溶液由无色变蓝色 | 假设2和假设3均成立 |
该化学兴趣小组经交流讨论后,设计了如下两方案:
【方案一】称取5.00g红色固体加入到足量稀硫酸溶液中使其充分反应后,操作A、洗涤、干燥,称量得红色固体质量为4.20g.
(1)操作A的名称是过滤,在实验室中完成操作A的玻璃仪器有玻璃棒、烧杯和漏斗;
(2)检验反应后剩余红色固体是否洗涤干净的方法是:取少量最后一次洗涤液,加入氢氧化钠溶液,如果观察到现象:无蓝色沉淀生成,说明已洗涤干净.
(3)通过计算,假设3成立,红色固体产物中Cu2O的含量为1.44g;
【方案二】称取5.00g的红色固体,用如图所示装置进行实验(固定装置略去,碱石灰为氧化钙和氢氧化钠的混合物),通过测定反应前后装置d的质量达到实验目的.
(1)装置a中用稀硫酸而不用稀盐酸,原因是盐酸挥发出氯化氢气体,与d中的物质反应,影响测定结果;
(2)装置b的作用是干燥氢气,若不加装置b,实验结果会偏大(“偏大”或“偏小”);
(3)装置c中涉及的反应化学方程式Cu2O+H2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+H2O;
(4)装置e的作用是防止空气中CO2及H2O对装置d的测量造成误差,若不加装置e,实验结果会偏大(“偏大”或“偏小”);
(5)点燃酒精灯前涉及的部分操作如下,
①连接仪器;②检查装置的气密性;
③关闭K2,打开K1,通氢气一段时间以赶尽装置内原有的空气,其目的是:a.防止空气中的H2O和CO2进入装置d干扰测定;b.防氢气不纯,发生爆炸,检验空气是否赶尽的方法是:在K1处用小试管收集气体,进行点燃;④打开K2,关闭K1
(6)经测定反应前后装置d的质量分别为100.00g、100.18g,计算产物中Cu2O的含量(写出计算过程,最后结果保留小数点后1位);
【交流与反思】
(1)在方案一实验测定中,若测定结果偏大,则下列可能的原因有①、②.(填序号)
①反应后剩余红色固体未洗涤干净 ②洗涤后未完全干燥
③干燥方法采用的是在空气中加热烘干 ④称量剩余红色固体时,有部分固体洒落到实验台上
(2)方案二中利用同样的装置,还可通过测定反应前后装置c(填“a”、“b”或“c”)的质量达到实验目的.

6.洁净的空气对人类的健康是非常重要的,下列影响空气质量的一组主要污染物是( )
| A. | 二氧化硫 二氧化氮 二氧化碳 | B. | 二氧化硫 二氧化氮 一氧化碳 | ||
| C. | 二氧化碳 氮气 稀有气体 | D. | 一氧化碳 氧气 可吸入颗粒物 |
13.下列对一些事实的解释中,不合理的是( )
| 事实 | 解释 | |
| A | 春天,丁香花花香四溢 | 分子在不断运动 |
| B | H2O和H2O2的性质不同 | 组成元素相同,分子构成不同 |
| C | 氧气和氢气在点燃的条件下可以生成水 | 化学反应实质是分子的再分和原子的重组 |
| D | 体温计中的汞随着温度的升高体积变大 | 分子间的间隔随温度变化而变化 |
| A. | A | B. | B | C. | C | D. | D |
10.下列物质的用途与性质不对应的是( )
| A. | 食品包装中充氦气以防腐-常温下氦气的化学性质不活泼 | |
| B. | 一氧化碳用于冶炼金属-一氧化碳难溶于水 | |
| C. | 稀有气体能制成多种用途的电光源-稀有气体在通电时发出不同颜色的光 | |
| D. | 干冰可用做制冷剂-干冰升华吸热 |