题目内容
1.下列现象的微观解释中,不正确的是( )| A. | 水蒸发为水蒸气,体积变大.温度升高,分子变大 | |
| B. | 3000L液化气在加压的情况下可装入20L的刚瓶中.-压强增大,分子间的间隔变小 | |
| C. | 香水、汽油要密封保存.-分子在不停的运动 | |
| D. | 湿衣服在阳光下比在阴凉处干得快.温度越高,分子运动的速度越快 |
分析 根据分子的基本特征:分子质量和体积都很小;分子之间有间隔;分子是在不断运动的;同种的分子性质相同,不同种的分子性质不同,可以简记为:“两小运间,同同不不”,结合事实进行分析判断即可.
解答 解:A、水蒸发为水蒸气,体积变大,是因为温度升高,分子间的间隔增大,故选项解释错误.
B、3000L液化气在加压的情况下可装入20L的刚瓶中,是因为分子间有间隔,气体受压后,分子间隔变小,故选项解释正确.
C、香水、汽油要密封保存,是因为分子在不停的运动的,防止运动到空气中造成浪费,故选项解释正确.
D、湿衣服在阳光下比在阴凉处干得快,是因为阳光下温度高,分子运动的速度加快,故选项解释正确.
故选:A.
点评 本题难度不大,掌握分子的基本性质(可以简记为:“两小运间,同同不不”)及利用分子的基本性质分析和解决问题的方法是解答此类题的关键.

练习册系列答案
相关题目
11.某研究性学习小组对“氯碱工业”生产的烧碱样品(可能含有碳酸钠、氯化钠等杂质)进行如下探究.
Ⅰ.定性探究
实验证明
Ⅱ.定量探究:
用下列装置测量烧碱样品中含碳酸钠的质量分数(提示:碱石灰成分为CaO和NaOH).请回答下列问题:
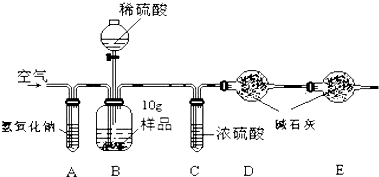
(1)装置A中氢氧化钠溶液的作用是除去空气中的二氧化碳气体;
(2)为什么先通一会儿空气后再进行装置B的化学反应,原因是将容器中的空气排干净,减小实验误差;
(3)写出装置B中化学反应产生气泡的化学方程式Na2CO3+H2SO4═Na2SO4+H2O+CO2↑,在滴加稀硫酸时,为什么要滴加到不再产生气泡为止保证将样品中的碳酸钠反应完,使测量结果更准确;
(4)本实验通过碱石灰增重测定CO2的质量,E装置的作用是吸收从装置右侧进入的空气的CO2.要称量的装置是D(填D或E或D、E).
Ⅰ.定性探究
实验证明
| 实验步骤 | 实验现象 | 解释或结论 |
| ①取适量烧碱样品置于试管中,加水溶解,并用手触摸试管外壁. | 试管外壁发热 | 原因是氢氧化钠溶于水放热 |
| ②向①所得的溶液中逐滴加入过量稀硝酸 | 一开始无明显现象,一段时间后产生能使澄清石灰水变浑浊的气体. | 样品中含有的 杂质是碳酸钠. |
| ③向②所得的溶液中滴加几滴硝酸银溶液 | 产生白色沉淀 | 样品中还含有的杂 质是氯化钠 |
用下列装置测量烧碱样品中含碳酸钠的质量分数(提示:碱石灰成分为CaO和NaOH).请回答下列问题:

(1)装置A中氢氧化钠溶液的作用是除去空气中的二氧化碳气体;
(2)为什么先通一会儿空气后再进行装置B的化学反应,原因是将容器中的空气排干净,减小实验误差;
(3)写出装置B中化学反应产生气泡的化学方程式Na2CO3+H2SO4═Na2SO4+H2O+CO2↑,在滴加稀硫酸时,为什么要滴加到不再产生气泡为止保证将样品中的碳酸钠反应完,使测量结果更准确;
(4)本实验通过碱石灰增重测定CO2的质量,E装置的作用是吸收从装置右侧进入的空气的CO2.要称量的装置是D(填D或E或D、E).
9.如图实验基本操作中,正确的是( )
| A. |  送入药品 | B. |  存放氢气 | C. |  溶解固体 | D. |  稀释浓硫酸 |
16. 溶液的应用非常广泛K2CO3和KNO3在不同温度时的溶解度及其溶解度曲线如图表:
溶液的应用非常广泛K2CO3和KNO3在不同温度时的溶解度及其溶解度曲线如图表:
(1)图1中能表示KNO3溶解曲线的是甲(填“甲”或“乙”)
(2)曲线上M点的含义是t1℃时,KNO3和K2CO3的溶解度相同.
(3)40℃时,向两个分别盛有相同质量的硝酸钾和碳酸钾的烧杯中,各加入100g水,充分溶解后,恢复至40℃,其结果如图2所示.
下列有关说法中,正确的有BD.(填字母)
A.烧杯①中溶解的是KNO3,烧杯②中溶解的是K2CO3
B.烧杯②中溶液是不饱和溶液
C.升高温度或增加溶剂都有可能将烧杯①中固体全部溶解
D.若将烧杯①中的溶液变为不饱和溶液,溶液中溶质质量分数一定减小
E.将得到的烧杯②中溶液降温至20℃时,溶液中溶质质量分数可能不变.
 溶液的应用非常广泛K2CO3和KNO3在不同温度时的溶解度及其溶解度曲线如图表:
溶液的应用非常广泛K2CO3和KNO3在不同温度时的溶解度及其溶解度曲线如图表:| 温度/℃ | 20 | 30 | 50 | 60 | 80 | |
| 溶解度/g | K2CO3 | 110 | 114 | 121 | 126 | 139 |
| KNO3 | 31.6 | 45.8 | 85.5 | 110 | 169 | |
(2)曲线上M点的含义是t1℃时,KNO3和K2CO3的溶解度相同.
(3)40℃时,向两个分别盛有相同质量的硝酸钾和碳酸钾的烧杯中,各加入100g水,充分溶解后,恢复至40℃,其结果如图2所示.
下列有关说法中,正确的有BD.(填字母)
A.烧杯①中溶解的是KNO3,烧杯②中溶解的是K2CO3
B.烧杯②中溶液是不饱和溶液
C.升高温度或增加溶剂都有可能将烧杯①中固体全部溶解
D.若将烧杯①中的溶液变为不饱和溶液,溶液中溶质质量分数一定减小
E.将得到的烧杯②中溶液降温至20℃时,溶液中溶质质量分数可能不变.
6.生活处处有化学,现有以下常见的物质:
A.铁B.铝C.氯化钠D.明矾
请按要求填空(填字母,每个字母限用一次):
(1)制作高压锅的材料是B
(2)食盐的主要成分是C
(3)可作为浑浊的天然水净水剂的是D.
A.铁B.铝C.氯化钠D.明矾
请按要求填空(填字母,每个字母限用一次):
(1)制作高压锅的材料是B
(2)食盐的主要成分是C
(3)可作为浑浊的天然水净水剂的是D.
10. 某同学设计了以下三个实验(如图所示)证明金属的活动性强弱.要排列出Cu、Zn、Ag的活动性顺序,必须要做的实验是( )
某同学设计了以下三个实验(如图所示)证明金属的活动性强弱.要排列出Cu、Zn、Ag的活动性顺序,必须要做的实验是( )
 某同学设计了以下三个实验(如图所示)证明金属的活动性强弱.要排列出Cu、Zn、Ag的活动性顺序,必须要做的实验是( )
某同学设计了以下三个实验(如图所示)证明金属的活动性强弱.要排列出Cu、Zn、Ag的活动性顺序,必须要做的实验是( )| A. | ②③ | B. | ①③ | C. | ①② | D. | ①②③ |
11.过氧化钠(化学式为Na2O2)可用子啊呼吸面具中作为氧气来源,Na2O2能跟CO2反应生成O2和另一种固体化合物(用X表示),它也能跟H2O反应生成O2,化学方程式为2Na2O2+2H2O═4NaOH+O2↑.以下是某兴趣小组进行的探究活动.

(1)如图所示实验装置制取氧气,请回答有关问题.
①能用D装置收集氧气的原因是氧气的密度比空气大;
②能用带火星的木条检验氧气,说明氧气有助燃的性质;
③表明CO2未被Na2O2完全吸收的实验现象为澄清石灰水变浑浊;
④若A装置产生的CO2中混有水蒸气,要检验干燥的CO2能否与Na2O2反应生成O2,以上实验装置应如何改进?在A、B装置之间和B、C装置之间增加气体干燥装置.
(2)为探究X是哪种物质,同学们进行了如下分析和实验.
①有同学猜想X可能是酸、碱或盐中的一种,通过对物质组成的分析,大家一致认为X肯定不是酸和碱,理由是Na2O2和CO2都不含氢元素,二者反应后不可能生成含氢元素的酸或碱;
②某同学猜想X可能是Na2CO3,请你跟他一起完成下列实验探究.
反思与拓展:
(3)写出过氧化钠与二氧化碳反应的化学方程式2Na2O2+2CO2═2Na2CO3+O2,该反应中过氧化钠与氧气的质量比为39:8.

(1)如图所示实验装置制取氧气,请回答有关问题.
①能用D装置收集氧气的原因是氧气的密度比空气大;
②能用带火星的木条检验氧气,说明氧气有助燃的性质;
③表明CO2未被Na2O2完全吸收的实验现象为澄清石灰水变浑浊;
④若A装置产生的CO2中混有水蒸气,要检验干燥的CO2能否与Na2O2反应生成O2,以上实验装置应如何改进?在A、B装置之间和B、C装置之间增加气体干燥装置.
(2)为探究X是哪种物质,同学们进行了如下分析和实验.
①有同学猜想X可能是酸、碱或盐中的一种,通过对物质组成的分析,大家一致认为X肯定不是酸和碱,理由是Na2O2和CO2都不含氢元素,二者反应后不可能生成含氢元素的酸或碱;
②某同学猜想X可能是Na2CO3,请你跟他一起完成下列实验探究.
| 操作步骤 | 实验现象 | 结论及化学方程式 |
| 取反应后的剩余固体于试管中,加适量的水完全溶解后,加入氯化钙溶液 | 产生白色沉淀 | 该固体X是Na2CO3相关的化学方程式Na2CO3+CaCl2═CaCO3↓+2NaCl |
(3)写出过氧化钠与二氧化碳反应的化学方程式2Na2O2+2CO2═2Na2CO3+O2,该反应中过氧化钠与氧气的质量比为39:8.
