��Ŀ����
��ҵ���õ�ⱥ��NaCl��Һ�ķ�������ȡNaOH��Cl2��H2����������Ϊԭ������һϵ�л�����Ʒ����Ϊ�ȼҵ���ڹ�ҵ�ϣ���ȡ�������ռ����Ҫ�����������£�
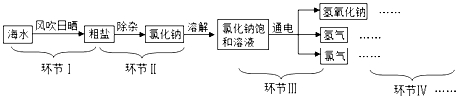
���ڢ����ú�ˮ��ȡ���εĹ��̣���ͼ����
��1��ͼ�Т��������������������ȴ�����أ�
��2��ĸҺΪ�Ȼ��Ƶ�����������͡������͡�����Һ��
���ڢ����ù�ҵ�ϴ��Σ���MgCl2��CaCl2��Na2SO4�����ʣ������Ȼ��ƣ�����������ͼ����
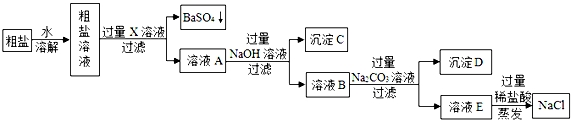
��1��X����������������
��2��д�����ɳ���D��һ����ѧ����ʽ������
��3����ҺE�мӹ���ϡ�����������������
��4��ʵ�����þ��ε��������ڴ�����NaCl��������ԭ��������
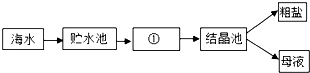
���ڢ�ⱥ��ʳ��ˮ�����������ռ�ⶨ�ռ�Ĵ��ȣ�
��1����д�����ڢ������з�����Ӧ�Ļ�ѧ����ʽ������
��2����ҵ�ռ������һ�����Ȼ��ƺ�̼�������ʣ�Ϊ�˲ⶨ�ռ�ĺ�����С��ͬѧ���̽�����������ʵ�鲢���������ͼ��

��������С��ͬѧ��õ����ݼ����ռ���Ʒ���������Ƶ��������������г�������̣�����
��3��Сǿͬѧ��ΪС��ͬѧ��Ƶ�̽�������������ܣ��������ǣ�
��̽��������û�����������Ƶ���ˮ�ԣ�
��̽����������ȱ����������������ƣ������²�õ��������Ƶ���������ƫС��
���ڢ���Ӧ�þ���
����������������Һ��Ӧ�Ļ�ѧ����ʽΪ��Cl2+2NaOH�TNaCl+NaClO+H2O����ҵ����������ʯ����[Ca��OH��2]��Ӧ����ȡƯ�ۣ��йط�Ӧ�Ļ�ѧ����ʽ������
����������1�������Ȼ��Ƶ��ܽ�����¶�Ӱ��仯�����������ᾧ�ķ������з�����з������
��2����������������ĸҺ�������ܽ��ܽ��Ȼ��ƽ��з������
��1�����ݼ��������X���������ᱵ����������X���Ȼ�����Һ���з�����
��2������̼������Ӻ����ӡ������ӻ�����̼��Ƴ�����̼�ᱵ�������з�����
��3�����ݼ���Ĺ�����̼���ƺ��������ƶ����Ȼ���Ҳ�����ʽ��з�����
��4�������������ơ�̼���ƺ����ᷴӦ���������Ȼ��ƽ��з�����
��1�����ݱ����Ȼ�����Һ��ͨ��������������������ơ��������������з�����
��2�����ݶ�����̼�����������̼���Ƶ������������Ȼ���������������Ȼ��Ƶ�������Ȼ�����̼���Ƶ�����������
��3�����ݳ��������մ�������������ʽ��з�����
�������������������Ʒ�Ӧ���ɴ�����ƺ��Ȼ��ơ�ˮ���з�����
����𡿽⣺��1���Ȼ��Ƶ��ܽ�����¶�Ӱ��仯�����������ᾧ�ķ������з��룬����ͼ�Т��������أ�
��2������������ĸҺ�������ܽ��ܽ��Ȼ��ƣ�Ϊ�Ȼ��Ƶı�����Һ��
��1�����������X���������ᱵ����������X���Ȼ�����Һ��X�к��е���������Ba2+��
��2����̼������Ӻ����ӡ������ӻ�����̼��Ƴ�����̼�ᱵ�������������ɳ���D��һ����ѧ����ʽ�ǣ�CaCl2+Na2CO3=CaCO3��+2NaCl��BaCl2+Na2CO3=BaCO3��+2NaCl��
��3������Ĺ�����̼���ƺ��������ƶ����Ȼ���Ҳ�����ʣ�������ҺE�мӹ���ϡ����������ǣ�����������̼���ƺ��������ƣ�
��4���������ơ�̼���ƺ����ᷴӦ���������Ȼ��ƣ�����ʵ�����þ��ε��������ڴ�����NaCl��������
��1�������Ȼ�����Һ��ͨ��������������������ơ���������������ѧ����ʽΪ��2NaCl+2H2O 2NaOH+H2��+Cl2����
2NaOH+H2��+Cl2����
��2����μӷ�Ӧ��̼��������Ϊx
Na2CO3+2HCl�T2NaCl+H2O+CO2����
106 44
x  0.22g
0.22g
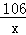 =
=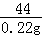
x=0.53g
������Ʒ�к���̼��������Ϊ��1.06g��
��μӷ�Ӧ���Ȼ�������Ϊy
NaCl+AgNO3=NaNO3+AgCl��
58.5 143.5
y 2.87g
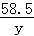 =
=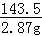
y=1.17g
������Ʒ�к����Ȼ�������Ϊ��2.34g
�����ռ���Ʒ�к����������Ƶ���������Ϊ��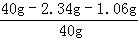 ��100%=91.5%��
��100%=91.5%��
��3�����������մ�������������ʣ�������Ҫϴ�Ӻ��ܽ��г�����
���������������Ʒ�Ӧ���ɴ�����ƺ��Ȼ��ơ�ˮ����ѧ����ʽΪ��2Cl2+2Ca��OH��2=CaCl2+Ca��ClO��2+2H2O��
�ʴ�Ϊ�����ڢ�1��������
��2�����ͣ�
���ڢ�1��Ba2+��
��2��Na2CO3+CaCl2=CaCO3��+2NaCl ����Na2CO3+BaCl2=BaCO3��+2NaCl����
��3�������������������ƺ�̼���ƣ�
��4�����ӹ����л�����һЩ�Ȼ��ƣ�
���ڢ�1��2NaCl+2H2O 2NaOH+H2��+Cl2����
2NaOH+H2��+Cl2����
��2��NaOH%=91.5%��
��3����ϴ�ӣ�
���ڢ���2Cl2+2Ca��OH��2=CaCl2+Ca��ClO��2+2H2O��

 �±�Сѧ��Ԫ�Բ���ϵ�д�
�±�Сѧ��Ԫ�Բ���ϵ�д� �ִʾ��ƪϵ�д�
�ִʾ��ƪϵ�д�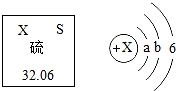
 N2��+Cl2��+4X��+2O2������X�Ļ�ѧʽΪ��������
N2��+Cl2��+4X��+2O2������X�Ļ�ѧʽΪ��������
 CO2 B��2CO+O2
CO2 B��2CO+O2