题目内容
盐酸、硫酸是两种重要的酸,回答与它们有关的下列问题.
(1)打开两瓶分别盛有浓硫酸和浓盐酸的试剂瓶,瓶口出现白雾的是 ;
(2)它们都能除铁锈,写出盐酸与铁锈主要成分反应的化学方程式 ;
(3)它们都能与碱反应生成盐和水,该类反应属于 反应(填基本反应类型);
(4)稀盐酸和稀硫酸具有相似化学性质的微观本质是 .
【考点】酸的化学性质;酸的物理性质及用途;中和反应及其应用;书写化学方程式、文字表达式、电离方程式.
【专题】常见的酸 酸的通性.
【分析】(1)根据浓盐酸具有强烈的挥发性解答;
(2)根据酸溶液都能和某些金属氧化物发生复分解反应生成盐和水解答;
(3)根据酸和碱之间的反应叫中和反应解答;
(4)根据稀盐酸和稀硫酸具有相似化学性质的微观本质是在溶液中都能解离出氢离子解答.
【解答】解:
(1)由于浓盐酸具有强烈的挥发性,故答案为:浓盐酸;
(2)由于酸溶液都能和某些金属氧化物发生复分解反应生成盐和水,两者均能与铁锈中的主要成分氧化铁反应,盐酸和氧化铁反应的方程式为:Fe2O3+6HCl=2FeCl3+3H2O;
(3)酸和碱之间的反应叫中和反应,是复分解反应的一种;
(4)稀盐酸和稀硫酸具有相似化学性质的微观本质是在溶液中都能解离出氢离子.
答案:
(1)浓盐酸;
(2)Fe2O3+6HCl=2FeCl3+3H2O;
(3)复分解;
(4)在溶液中都能解离出氢离子
【点评】本题难度不是很大,主要考查了酸的有关的化学性质,从而培养学生对知识的灵活运用的能力.

练习册系列答案
相关题目

 、
、
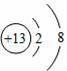
 的粒子,表示了同种元素不同的粒子
的粒子,表示了同种元素不同的粒子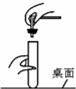





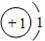
 B.
B.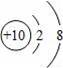
 C.
C.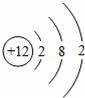
 D.
D.