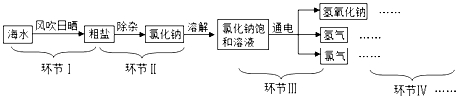
题目内容
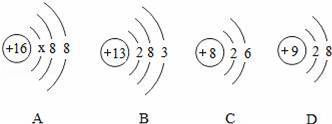
在元素周期表中,硫元素的信息如图所示,下列从图中获得的信息不正确的是( )
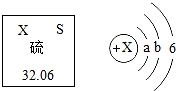
A.在硫原子的核外电子排布中a=2和b=8
B.硫原子在化学反应中易获得2个电子生成S2﹣
C.硫原子里,质子数=中子数=电子数=16
D.一个硫原子的相对原子质量是32.06克
【分析】A、根据原子核外第一层上有2个电子、第二层上有8个电子,进行分析判断.
B、若原子的最外层电子数≥4,在化学反应中易得电子,若最外层电子数<4,在化学反应中易失去电子.
C、左上角的数字表示原子序数,汉字下面的数字表示相对原子质量,进行分析判断即可.
D、汉字下面的数字表示相对原子质量,据此进行分析判断.
【解答】解:A、原子核外第一层上有2个电子、第二层上有8个电子,在硫原子的核外电子排布中a=2和b=8,故选项说法正确.
B、硫原子的最外层电子数是6,大于4,在化学反应中易得到2个电子而形成S2﹣,故选项说法正确.
C、根据元素周期表中的一格可知,左上角的数字为16,表示原子序数为16;根据原子序数=核电荷数=质子数=核外电子数,则该 元素的原子核内质子数和核外电子数均为16;汉字下面的数字表示相对原子质量,硫元素的相对原子质量为32.06≈32,相对原子质量=质子数+中子数,则中子数=32﹣16=16,故选项说法正确.
元素的原子核内质子数和核外电子数均为16;汉字下面的数字表示相对原子质量,硫元素的相对原子质量为32.06≈32,相对原子质量=质子数+中子数,则中子数=32﹣16=16,故选项说法正确.
D、根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,硫元素的相对原子质量为32.06,相对原子质量单位是“1”,不是“克”,故选项说法错误.
故选:D.

练习册系列答案
相关题目