题目内容
15. 某学习小组在探究碳酸钠的化学性质时,做了下图所示的三个实验.
某学习小组在探究碳酸钠的化学性质时,做了下图所示的三个实验.(1)实验一:探究碳酸钠溶液的酸碱性.观察到试管中溶液变为红色,可得出的结论是碳酸钠溶液显碱性.
实验二:探究碳酸钠与稀盐酸的反应.试管中产生大量气泡,该反应的化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑.
实验三:探究碳酸钠与氢氧化钙溶液的反应.试管中产生白色沉淀,该白色沉淀为碳酸钙或CaCO3.
(2)小组同学将实验三试管内液体进行过滤,对滤液中溶质的成分展开了探究.请你一起参与.
【提出猜想】
猜想一:滤液中溶质是氢氧化钠;
猜想二:滤液中溶质是氢氧化钠、氢氧化钙和碳酸钠;
猜想三:滤液中溶质是氢氧化钠、氢氧化钙;
猜想四:滤液中溶质是氢氧化钠、碳酸钠.
通过讨论,大家一致认为猜想二不成立,理由是氢氧化钙与碳酸钠能反应不能共存.
【实验验证】
小组同学通过以下实验验证了猜想三成立,请你完成实验报告.
| 实验步骤 | 实验现象 | 实验结论 |
| 取实验三少量滤液于试管 中,通入二氧化碳气体 | 产生白色沉淀 | 猜想三成立 |
色溶液,则实验二试管中溶液含有的溶质为氯化钠、氯化氢(或NaCl、HCl).
分析 (1)实验一:考虑碳酸钠溶液的显碱性.
实验二:考虑碳酸钠与稀盐酸的反应生成氯化钠、水、二氧化碳;
实验三:考虑碳酸钠与氢氧化钙的反应生成白色沉淀碳酸钙.
(2)考虑反应物、生成物,进行分析猜想四:滤液中溶质成分;
【讨论】考虑氢氧化钙与碳酸钠能反应.
【实验验证】考虑氢氧化钙溶液与二氧化碳反应生成碳酸钙白色沉淀;
(3)考虑实验一、实验二的溶液倒入同一洁净的烧杯时,反应物是否剩余,根据无色溶液,推测实验二试管中溶液含有的溶质.
解答 解:(1)实验一:因为碳酸钠溶液的显碱性,故滴加酚酞溶液,可观察到试管中溶液变为红色.
实验二:因为碳酸钠与稀盐酸的反应生成氯化钠、水、二氧化碳,故该反应的化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑.
实验三:因为碳酸钠与氢氧化钙的反应生成碳酸钙,故该白色沉淀为碳酸钙或CaCO3.
(2)【猜想】因为实验三试管内反应物为氢氧化钙和碳酸钠,二者反应生成碳酸钙沉淀和氢氧化钠,过滤后,滤液中溶质的成分为:
如果氢氧化钙和碳酸钠恰好反应,则滤液中溶质是氢氧化钠;
如果氢氧化钙过量,则滤液中溶质是氢氧化钠、氢氧化钙;
如果碳酸钠过量,则滤液中溶质是氢氧化钠、碳酸钠.
【讨论】因为氢氧化钙与碳酸钠能反应不能共存,故大家一致认为猜想二不成立.
【实验验证】已知“猜想三:滤液中溶质是氢氧化钠、氢氧化钙”,取实验三少量滤液与试管中,通入二氧化碳气体,如果产生白色沉淀,则猜想三成立;
(3)实验结束,小组同学对废液进行处理,将实验一、实验二的溶液倒入同一洁净的烧杯时,得到无色溶液,则说明溶液显中性或酸性;则实验二试管中溶液含有的溶质为氯化钠、氯化氢(NaCl、HCl).
故答案为:
(1)碳酸钠溶液显碱性; Na2CO3+2HCl=2NaCl+H2O+CO2↑;碳酸钙或CaCO3;
(2)氢氧化钠、碳酸钠; 氢氧化钙与碳酸钠能反应不能共存;产生白色沉淀;
(3)氯化钠、氯化氢(或NaCl、HCl).
点评 本题为典型的实验探究中的实验分析题,只有熟练掌握所学知识才能明白实验的设计,才能顺利得出正确答案.

| A. | 食物腐烂 | B. | 酒精挥发 | C. | 瓷碗破碎 | D. | 空气液化 |
①CaCl2→NaCl ②CO2→CO ③Fe2O3→FeCl2 ④Na2SO4→NaOH.
| A. | ①③④ | B. | ②③④ | C. | ①②③ | D. | ①②④ |
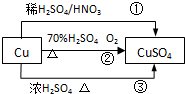 CuSO4是一种重要的化工原料,其有关制备途径如图所示.下列说法不正确的是( )(已知:2Cu+O2+2H2SO4→2CuSO4+2H2O)
CuSO4是一种重要的化工原料,其有关制备途径如图所示.下列说法不正确的是( )(已知:2Cu+O2+2H2SO4→2CuSO4+2H2O)| A. | 相对于途径①、③,途径②更好地体现了绿色化学思想 | |
| B. | 途径③中,1mol Cu与足量浓硫酸反应会产生64g SO2气体 | |
| C. | 途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2 | |
| D. | 1mol Cu分别按照途径②、③中,被还原的H2SO4的质量之比为1:1 |
| A. | 过滤 | B. | 蒸馏 | C. | 吸附沉淀 | D. | 静置沉淀 |
| A. | CO2 | B. | CH4 | C. | O3 | D. | O2 |
| A. | 将空的集气瓶瓶口向下浸入水中,水不能进入集气瓶中 | |
| B. | 将由射器栓塞拉到10mL刻度处,用食指抵住针孔,栓塞不能推到底部 | |
| C. | 伽利略在比萨斜塔上将两个大小不同的铁球同时落下,发现两铁球同时着地 | |
| D. | 晓明在家中阳台上将玻璃弹子和纸片同时丢下,发现玻璃弹子先着地、纸片后着地 |

