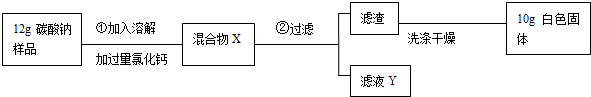
题目内容
20.下列净水方法中,对水的净化程度相对较高的是( )| A. | 过滤 | B. | 蒸馏 | C. | 吸附沉淀 | D. | 静置沉淀 |
分析 根据吸附可以除去水中的色素和异味;沉淀、过滤可以除去不溶于水的物质;蒸馏可以得到几乎纯净的水解答.
解答 解:在吸附、沉淀、过滤、蒸馏等净化水的方法中,蒸馏可以得到几乎纯净的水,净化程度较高.
故选B.
点评 吸附、沉淀、过滤等方法中,每种方法只是除去水中的一部分杂质,而蒸馏几乎可以把水中的杂质全部除去.

练习册系列答案
 全优测试卷系列答案
全优测试卷系列答案 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
10.下列现象或事实,用分子的相关知识加以解释,其中错误的是( )
| A. | 闻到花的香味,说明分子不断地运动 | |
| B. | 热胀冷缩,说明分子大小随温度改变而改变 | |
| C. | 水通电后生成氢气和氧气,说明在化学变化中分子可以再分 | |
| D. | 50mL的酒精和50mL的水混合后体积小于100mL,说明分子之间有间隔 |
15. 某学习小组在探究碳酸钠的化学性质时,做了下图所示的三个实验.
某学习小组在探究碳酸钠的化学性质时,做了下图所示的三个实验.
(1)实验一:探究碳酸钠溶液的酸碱性.观察到试管中溶液变为红色,可得出的结论是碳酸钠溶液显碱性.
实验二:探究碳酸钠与稀盐酸的反应.试管中产生大量气泡,该反应的化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑.
实验三:探究碳酸钠与氢氧化钙溶液的反应.试管中产生白色沉淀,该白色沉淀为碳酸钙或CaCO3.
(2)小组同学将实验三试管内液体进行过滤,对滤液中溶质的成分展开了探究.请你一起参与.
【提出猜想】
猜想一:滤液中溶质是氢氧化钠;
猜想二:滤液中溶质是氢氧化钠、氢氧化钙和碳酸钠;
猜想三:滤液中溶质是氢氧化钠、氢氧化钙;
猜想四:滤液中溶质是氢氧化钠、碳酸钠.
通过讨论,大家一致认为猜想二不成立,理由是氢氧化钙与碳酸钠能反应不能共存.
【实验验证】
小组同学通过以下实验验证了猜想三成立,请你完成实验报告.
(3)实验结束,小组同学对废液进行处理.将实验一、实验二的溶液倒入同一洁净的烧杯时,得到无
色溶液,则实验二试管中溶液含有的溶质为氯化钠、氯化氢(或NaCl、HCl).
 某学习小组在探究碳酸钠的化学性质时,做了下图所示的三个实验.
某学习小组在探究碳酸钠的化学性质时,做了下图所示的三个实验.(1)实验一:探究碳酸钠溶液的酸碱性.观察到试管中溶液变为红色,可得出的结论是碳酸钠溶液显碱性.
实验二:探究碳酸钠与稀盐酸的反应.试管中产生大量气泡,该反应的化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑.
实验三:探究碳酸钠与氢氧化钙溶液的反应.试管中产生白色沉淀,该白色沉淀为碳酸钙或CaCO3.
(2)小组同学将实验三试管内液体进行过滤,对滤液中溶质的成分展开了探究.请你一起参与.
【提出猜想】
猜想一:滤液中溶质是氢氧化钠;
猜想二:滤液中溶质是氢氧化钠、氢氧化钙和碳酸钠;
猜想三:滤液中溶质是氢氧化钠、氢氧化钙;
猜想四:滤液中溶质是氢氧化钠、碳酸钠.
通过讨论,大家一致认为猜想二不成立,理由是氢氧化钙与碳酸钠能反应不能共存.
【实验验证】
小组同学通过以下实验验证了猜想三成立,请你完成实验报告.
| 实验步骤 | 实验现象 | 实验结论 |
| 取实验三少量滤液于试管 中,通入二氧化碳气体 | 产生白色沉淀 | 猜想三成立 |
色溶液,则实验二试管中溶液含有的溶质为氯化钠、氯化氢(或NaCl、HCl).
5.钛(Ti)广泛用于航空、航天等领域.生产钛的过程中存在反应:TiCl4+2Mg═Ti+2MgCl2.这一反应的反应类型为( )
| A. | 化合反应 | B. | 分解反应 | C. | 复分解反应 | D. | 置换反应 |
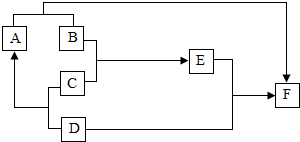 如图是某些常见物质之间转化关系,已知D为地壳中含量最多的金属元素的单质,B为氧化物,C是一种稀酸,其浓溶液用水稀释时会放出大量的热,E为蓝色溶液,A、F均为单质.试回答下列问题(框图中的反应条件和有些生成物已略去):
如图是某些常见物质之间转化关系,已知D为地壳中含量最多的金属元素的单质,B为氧化物,C是一种稀酸,其浓溶液用水稀释时会放出大量的热,E为蓝色溶液,A、F均为单质.试回答下列问题(框图中的反应条件和有些生成物已略去):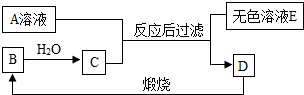 A、B、C、D是生活中常见的物质.已知A是含三种元素的钠盐,D是大理石的主要成分,它们之间的关系如图所示.请回答下列问题:
A、B、C、D是生活中常见的物质.已知A是含三种元素的钠盐,D是大理石的主要成分,它们之间的关系如图所示.请回答下列问题: