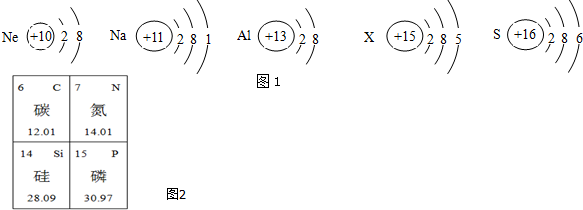
题目内容
11. 某化学课堂围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开展探究活动.以下是教学片段,请你参与学习并帮助填写空格(包括表中空格).
某化学课堂围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开展探究活动.以下是教学片段,请你参与学习并帮助填写空格(包括表中空格).【演示实验】将一定量的稀盐酸加入到盛有NaOH溶液的小烧杯中.
【学生板演】该反应的化学方程式HCl+NaOH═NaCl+H2O.
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么?
【假设猜想】甲组同学的猜想如下:
猜想一:溶质是NaCl与NaOH 猜想二:溶质只是NaCl 猜想三:溶质是HCl和NaCl.
【实验探究】
(1)乙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有NaOH.
(2)为了验证其余猜想,丙组同学想选用碳酸钠溶液完成实验,填写以下表格:
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量反应后的溶液于试管中,逐滴加入碳酸钠溶液. | 有气泡产生 | 猜想三正确 |
【实验拓展】如图是氢氧化钠溶液与盐酸反应的微观示意图.
反应的实质:氢氧化钠与盐酸反应的实质是氢氧根离子(OH-)与氢离子(H+)结合生成水.
分析 【学生板演】盐酸和氢氧化钠反应生成氯化钠和水,注意化学式的写法和配平;
【假设猜想】根据酸碱不能共存判断不合理的猜想;
【实验探究】(1)乙同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有NaOH或氢氧化钠.(2)盐酸会与碳酸钠反应生成氯化钠、水和二氧化碳.
【实验反思】根据溶液的pH以及酸碱的性质来分析;
【实验拓展】根据氢氧化钠溶液与盐酸反应的微观示意图分析.
解答 解:【学生板演】
氢氧化钠和稀盐酸反应生成氯化钠和水,该反应的化学方程式为:NaOH+HCl═NaCl+H2O.
故填:NaOH+HCl═NaCl+H2O.
【假设猜想】盐酸和氢氧化钠反应生成氯化钠和水,酸或碱可能过量,因此猜想三溶质是NaCl与HCl.
故填:NaCl与HCl.
【实验探究】
(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,说明溶液中一定没有氢氧化钠.
故填:氢氧化钠.
(2)要验证猜想三正确,即验证反应后溶液中含有盐酸,盐酸会与碳酸钠反应生成氯化钠、水和二氧化碳,所以会有气泡产生;
【实验反思】稀盐酸如果不与氢氧化钠反应,也会将溶液稀释,引起pH减小,但是氢氧化钠稀释,pH不会小于或等于7.
【实验拓展】由图可知氢氧化钠与盐酸反应的实质是氢氧根离子(OH-)与氢离子(H+)结合生成水.
故答案为:
【学生板演】HCl+NaOH═NaCl+H2O 猜想三:HCl NaCl
【实验探究】NaOH 有气泡产生
【实验反思】排除因稀盐酸的加入,稀释氢氧化钠溶液而引起pH减小的干扰.
【实验拓展】氢氧根离子(OH-)与氢离子(H+).
点评 此题通过中和反应考查了化学方程式的书写,实验方案设计、实验操作以及实验方案的评价,解答时要全面审题,认真解答

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案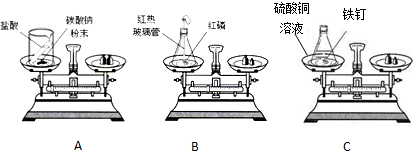
(1)上述实验方案中,不能用于验证质量守恒定律的是A(填字母序号),其原因是装置未密闭,反应生成的二氧化碳气体逸出,无法测得全部产物的质量.
(2)某反应在点燃的条件下发生,涉及甲、乙、丙和丁四种物质,它们的微观示意图和反应前后的质量如表.
| 物质序号 | 甲 | 乙 | 丙 | 丁 |  |
| 微观 示意图 |  |  |  |  | |
| 反应前质量/g | 68 | 100 | 1 | 0 | |
| 反应后质量/g | 0 | x | y | z |
②表中的四种物质中,含氧元素的化合物是丙、丁(填物质序号).
③上述反应的化学方程式为2H2S+3O2$\frac{\underline{\;点燃\;}}{\;}$2H2O+2SO2.
| A. | 化学反应前后,物质的质量总和是一样的 | |
| B. | 元素的种类是一样的 | |
| C. | 各种原子的总数是一样的 | |
| D. | 物质的分子的个数是一样的 |
| A. | 偏二甲肼是由碳、氢、氮三种元素组成的 | |
| B. | 偏二甲肼是由两个碳元素、八个氢元素、两个氮元素组成的 | |
| C. | 偏二甲肼中含有氮气 | |
| D. | 偏二甲肼中含有两个碳原子、八个氢原子、两个氦原子氧、氮四种元素组成 |
| A. |  用100mL量筒量取8.5mL浓硫酸 | B. |  稀释浓硫酸 | ||
| C. |  干燥氨气 | D. |  滴加稀硫酸 |
| A. | 生石灰中加入一定量的水:白色固体变成白色浆液,吸收大量的热 | |
| B. | 加热通入足量二氧化碳后的石蕊溶液:溶液由紫色变为红色 | |
| C. | 向硫酸铜溶液中插入铁丝:银白色固体表面覆盖一层紫红色固体,溶液由蓝色变成浅绿色 | |
| D. | 向氧化铁中加入足量的稀硫酸,黑色固体逐渐减少至消失,溶液由无色变为黄色 |
| A. | N2和H2 | B. | N2和CO2 | C. | N2和H2O | D. | N2和CO |