题目内容
1.质量守恒定律是化学反应遵循的普遍规律.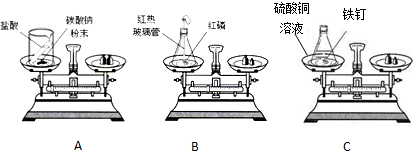
(1)上述实验方案中,不能用于验证质量守恒定律的是A(填字母序号),其原因是装置未密闭,反应生成的二氧化碳气体逸出,无法测得全部产物的质量.
(2)某反应在点燃的条件下发生,涉及甲、乙、丙和丁四种物质,它们的微观示意图和反应前后的质量如表.
| 物质序号 | 甲 | 乙 | 丙 | 丁 |  |
| 微观 示意图 |  |  | 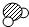 |  | |
| 反应前质量/g | 68 | 100 | 1 | 0 | |
| 反应后质量/g | 0 | x | y | z |
②表中的四种物质中,含氧元素的化合物是丙、丁(填物质序号).
③上述反应的化学方程式为2H2S+3O2$\frac{\underline{\;点燃\;}}{\;}$2H2O+2SO2.
分析 (1)做验证质量守恒定律的实验时所选用的装置应该考虑到:①如果反应物中有气体参加反应,或生成物中有气体生成,应该选用密闭装置.②如果反应物中没有气体参加生成物中也没有气体生成,装置可不考虑密闭.
(2)根据题中的图例进行判断该物质的化学式;根据图示结合含氧化合物的组成来判断;根据反应前后原子的种类不变来书写出该反应的化学方程式.
解答 解:(1)用图象A不能达到目的,因为生成的二氧化碳气体散逸到空气中去了.
图象B中的装置进行验证质量守恒定律,能达到目的,原因在于装置是密封的.
图象C也能达到目的,因为生成物和反应物中都没有气体产生.
(2)①由图示可知丁为二氧化硫;
②由图示可知含氧元素的化合物为丙和丁;
③上述反应的化学方程式为硫化氢和氧气反应生成水和二氧化硫;
故答案为:(1)A;装置未密闭,反应生成的二氧化碳气体逸出,无法测得全部产物的质量;(2)①SO2;②丙、丁;③2H2S+3O2$\frac{\underline{\;点燃\;}}{\;}$ 2H2O+2SO2.
点评 要想解答好这类题目,首先,要理解和熟记微粒观点及模型图的应用,以及与之相关的知识.然后,根据所给的问题情景或图表信息等,结合所学的相关知识和技能,并细心地探究、推理后,按照题目要求进行认真地选择或解答即可.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
6.我们已经知道:HCl在水中会解离出H+和Cl-,NaOH在水中会解离出Na+和OH-.请分析:下列各组离子在水溶液中一定能大量共存的是( )
| A. | Ba2+、H+、CO32- | B. | H+、OH-、Na+ | C. | Ag+、Cl-、NO3- | D. | Cu2+、Fe2+、SO42- |
10.关于合金的认识,下列正确的是( )
| A. | 合金就是生铁和钢 | B. | 合金具有金属特性 | ||
| C. | 纯铁是最常见的合金之一 | D. | 合金就是几种金属粉末混合在一起 |
11. 某化学课堂围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开展探究活动.以下是教学片段,请你参与学习并帮助填写空格(包括表中空格).
某化学课堂围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开展探究活动.以下是教学片段,请你参与学习并帮助填写空格(包括表中空格).
【演示实验】将一定量的稀盐酸加入到盛有NaOH溶液的小烧杯中.
【学生板演】该反应的化学方程式HCl+NaOH═NaCl+H2O.
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么?
【假设猜想】甲组同学的猜想如下:
猜想一:溶质是NaCl与NaOH 猜想二:溶质只是NaCl 猜想三:溶质是HCl和NaCl.
【实验探究】
(1)乙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有NaOH.
(2)为了验证其余猜想,丙组同学想选用碳酸钠溶液完成实验,填写以下表格:
【实验反思】氢氧化钠与稀盐酸发生中和反应观察不到明显现象,为了确定其反应是否反生,丁组同学设计了如下的实验方案:先用pH试纸测定氢氧化钠溶液的pH,然后向其中滴加稀盐酸,边滴边测定混合溶液的pH.请你分析上述方案中,为什么要“当测定pH小于或等于7,”才可证明发生反应了,其原因是排除因稀盐酸的加入,稀释氢氧化钠溶液而引起pH减小的干扰.
【实验拓展】如图是氢氧化钠溶液与盐酸反应的微观示意图.
反应的实质:氢氧化钠与盐酸反应的实质是氢氧根离子(OH-)与氢离子(H+)结合生成水.
 某化学课堂围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开展探究活动.以下是教学片段,请你参与学习并帮助填写空格(包括表中空格).
某化学课堂围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开展探究活动.以下是教学片段,请你参与学习并帮助填写空格(包括表中空格).【演示实验】将一定量的稀盐酸加入到盛有NaOH溶液的小烧杯中.
【学生板演】该反应的化学方程式HCl+NaOH═NaCl+H2O.
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么?
【假设猜想】甲组同学的猜想如下:
猜想一:溶质是NaCl与NaOH 猜想二:溶质只是NaCl 猜想三:溶质是HCl和NaCl.
【实验探究】
(1)乙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有NaOH.
(2)为了验证其余猜想,丙组同学想选用碳酸钠溶液完成实验,填写以下表格:
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量反应后的溶液于试管中,逐滴加入碳酸钠溶液. | 有气泡产生 | 猜想三正确 |
【实验拓展】如图是氢氧化钠溶液与盐酸反应的微观示意图.
反应的实质:氢氧化钠与盐酸反应的实质是氢氧根离子(OH-)与氢离子(H+)结合生成水.

 2015年我国纪念“世界水日”和“中国水周”活动的宣传主题为“节约水资源,保障水安全”.
2015年我国纪念“世界水日”和“中国水周”活动的宣传主题为“节约水资源,保障水安全”.
 A、B、C是铁丝在氧气里燃烧的实验操作图,试回答下列问题:
A、B、C是铁丝在氧气里燃烧的实验操作图,试回答下列问题: