题目内容
将一定质量的甲烷和一氧化碳的混合气体在足量的氧气中充分燃烧,将生成物依次通入盛有足量浓硫酸和氢氧化钠溶液的洗气瓶,实验测得装有浓硫酸的洗气瓶增重5.4克,装有氢氧化钠溶液的洗气瓶增重8.8克。试计算:
(1)混合气体中甲烷的质量(写出完整的计算过程)
(2)混合气体中甲烷和一氧化碳的质量之比为______,混合气体中碳、氢、氧三种元素的质量之比为_________。
【答案】(1)解:设混合气体中甲烷的质量为X

CH4 + 2O2 CO2 + 2H2O -----------------------------------1分
16 36
X 5.4g
16/X = 36/5.4g ---------------------------------1分
X=2.4g -----------------------------------------------------------1分
答:混合气体中甲烷的质量是2.4克。
(2) 12 :7(1分) 12 :3 :4 (1分)
【解析】解:(1)设:燃烧产生5.4g水,生成二氧化碳的质量为x,需要甲烷的质量为y
CH4+ 2O2
2O2 CO2+2H2O
CO2+2H2O
16 44 36
Y x 5.4g
 x=6.6g
x=6.6g
 y=2.4g
y=2.4g
(2)CO燃烧产生的CO2质量为8.8g-6.6g=2.2g
设:一氧化碳的质量为z
2CO+O2 2CO2
2CO2
56 88
Z 2.2g
 z=1.4g
z=1.4g
混合气体中甲烷和一氧化碳的质量之比为2.4g:1.4g=12:7
混合气体中碳元素质量为2.4g× +1.4g×
+1.4g× =1.8g+0.6g=2.4g;
=1.8g+0.6g=2.4g;
氢元素质量为2.4g× =0.6g;
=0.6g;
氧元素的质量为1.4g-0.6g=0.8g
所以混合气体中碳、氢、氧三种元素的质量之比为2.4g:0.6g:0.8g=12:3:4。

临近中考,家长为了给学生增加营养,制定了如下食谱:
| 主食 | 馒头、米饭 |
| 副食 | 红烧牛肉、清蒸西江鱼 |
| 饮料 | 酸牛奶、白开水 |
用你所学的知识,建议家长增加的食物是( )
A.炒鸡蛋 B.蒸猪排骨
C.炖豆腐 D.炒瓜苗
某氢氧化钙中含碳酸钙杂质。称取研细的该样品12.4g放入锥形瓶中,加入32.6g的水,充分振荡形成悬浊液,再向锥形瓶中逐滴滴加盐酸使其充分反应至无气泡产生。测得加入盐酸的质量与锥形瓶中的物质的质量关系如下表示。
| 加入盐酸的质量g | 0 | 25 | 37.5 |
| 锥形瓶中物质的质量 | 45 | 70 | 80.3 |
(1)加入盐酸的质量在0—25g时, 与盐酸发生反应。
(2)反应产生二氧化碳质量为 g。
(3)求样品中氢氧化钙的质量分数(写出计算过程,精确到0.1%)。




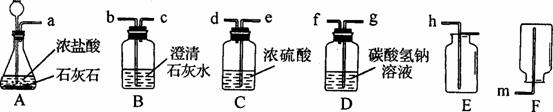 ①A中反应的化学方程式为___________________________________________________。
①A中反应的化学方程式为___________________________________________________。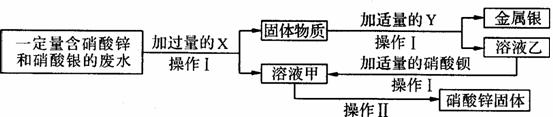 ①X为____;乙与硝酸钡反应的化学方程式为_____________________________________。
①X为____;乙与硝酸钡反应的化学方程式为_____________________________________。