题目内容
2. 小宁和小明同学学习完酸、碱、盐后发现:碱溶液能使酚酞试液变红,Na2CO3溶液也能使酚酞试液变红.碱溶液使酚酞试液变红是因为碱在水中解离出OH-,那么Na2CO3溶液中究竟是哪种粒子使酚酞试液变红的呢?小宁设计了如图所示三个实验,请你、小宁和小明一起探究并完成下列问题:
小宁和小明同学学习完酸、碱、盐后发现:碱溶液能使酚酞试液变红,Na2CO3溶液也能使酚酞试液变红.碱溶液使酚酞试液变红是因为碱在水中解离出OH-,那么Na2CO3溶液中究竟是哪种粒子使酚酞试液变红的呢?小宁设计了如图所示三个实验,请你、小宁和小明一起探究并完成下列问题:(1)Na2CO3 属于盐(填“酸”“碱”或“盐”).
(2)实验甲的目的是为了探究Na+是否能使酚酞试液变红.
(3)实验乙加入蒸馏水的目的是探究水分子是否能使酚酞试液变红,小明同学认为实验乙没必要做,你认为小明的理由是酚酞试液中就有水分子(或氯化钠溶液中含有水分子).
(4)实验丙滴入Na2CO3溶液,振荡,酚酞试液变红,向变红后的溶液中再逐滴滴加过量的CaCl2溶液后,振荡,红色消失(填“消失”或“不消失”),同时还观察到生成了白色沉淀(提示:CaCl2溶液呈中性).由实验甲、乙、丙得出结论:溶液中的CO32-能使酚酞试液变红.
(5)小明同学在和老师交流上述结论时,老师说:“其实Na2CO3溶液能使酚酞试液变红也是由于溶液中存在OH-”你认为Na2CO3溶液中存在OH-的原因是CO32-与H2O发生反应产生OH-.
分析 (1)电离出金属离子和酸根离子的化合物是盐
(2)氯化钠中含有钠离子,可以探究钠离子能否使酚酞变色;
(3)酚酞试液中就有水分子或氯化钠溶液中含有大量水分子,所以实验Ⅱ没有必要做;
(4)主要从碳酸钠溶液和氯化钙溶液的反应可以得出,碳酸根离子减少,使红色逐渐消失;
(5)氢氧根离子能够使酚酞变红,所以可以判断在碳酸钠溶液中存在氢氧根离子.
解答 解:(1)碳酸钠能电离出钠离子和碳酸根离子,所以属于盐;
(2)向氯化钠溶液中加酚酞不变色,说明氯化钠溶液中的粒子都不能使酚酞变红,即钠离子不能使酚酞变色;
(3)氯化钠溶液中含有大量水分子,在实验Ⅰ中得到验证,所以实验Ⅱ的探究是多余的;
(4)实验丙滴入Na2CO3溶液,振荡,酚酞试液变红,向变红后的溶液中再逐滴滴加过量的CaCl2溶液后,振荡,红色消失;碳酸钠溶液和氯化钙溶液反应生成碳酸钙沉淀,所以现象为产生了白色沉淀;
(5)我们知道只有氢氧根离子才能使酚酞变红,所以由碳酸钠溶液能使酚酞溶液变红,可以判断溶液中存在氢氧根离子,Na2CO3溶液中存在OH-的原因可能是CO32-与H2O发生反应产生了OH-;
故答案为:
(1)盐;
(2)探究Na+是否能使酚酞试液变红;
(3)酚酞试液中就有水分子(或氯化钠溶液中含有水分子);
(4)消失;白色沉淀;
(5)CO32-与H2O发生反应产生OH- (合理即可).
点评 本题考查了学生对所提供信息进行处理和利用微粒性质的差异进行实验设计的能力,要求较高.要熟悉对照实验的设计思路和方法.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.有X、Y、Z三种金属,只有Z在自然界中主要以单质形式存在,如果把Y加入X的硝酸盐溶液中,Y表面有X析出,则这三种金属的活动性由强到弱的顺序为( )
| A. | Y>Z>X | B. | Y>X>Z | C. | X>Y>Z | D. | Z>Y>X |
14.下列除去杂质的方法中,合理的是( )
| 选项 | 物质 | 杂质 | 除杂方法 |
| A | 铁粉 | 铜粉 | 加入足量的稀硫酸,过滤 |
| B | NaCl溶液 | NaOH溶液 | 加入适量CaCl2溶液,过滤 |
| C | CaCl2溶液 | 稀盐酸 | 加过量碳酸钙,过滤 |
| D | CaO | CaCO3 | 加入适量稀盐酸,过滤 |
| A. | A | B. | B | C. | C | D. | D |
11.如图所示四个图象中,所表示对应变化关系错误的是( )
| A. | 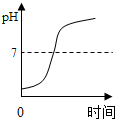 向一定量稀盐酸中加入氢氧化钠溶液 | |
| B. | 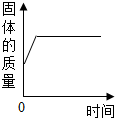 把金属铝放入硫酸铜溶液中 | |
| C. | 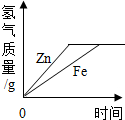 等质量的锌和铁分别与足量的稀硫酸反应 | |
| D. | 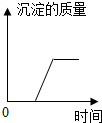 向盐酸和氯化镁的混合溶液中滴加氢氧化钾溶液 |
12.如图是元素X的原子结构示意图,下列说法正确的是( )
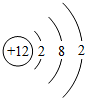
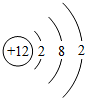
| A. | 该原子的化学性质稳定 | |
| B. | 该原子形成阳离子后核外电子数为10 | |
| C. | 该原子易形成阴离子 | |
| D. | X元素与Cl元素形成的化合物为XCl |
 据报道,有人将点着的鞭炮扔进排污井里,引发井内气体爆炸伤及路人.
据报道,有人将点着的鞭炮扔进排污井里,引发井内气体爆炸伤及路人. 如图是将氢氧化钠溶液逐滴滴入盐酸和氯化铜的混合溶液中所得的曲线,根据图示冋答问题.
如图是将氢氧化钠溶液逐滴滴入盐酸和氯化铜的混合溶液中所得的曲线,根据图示冋答问题.