题目内容
10.某化学兴趣小组的同学们要用溶质质量分数为19.6%的稀硫酸和锌粒反应来制取氢气,但实验室只有溶质质量分数为98%的浓硫酸.计算:(1)将10g溶质质量分数为98%的浓硫酸配成19.6%的稀硫酸,需要加水多少克?
(2)取上述配好的19.6%的稀硫酸20g与足量的锌粒充分反应,能制得氢气多少克?
分析 (1)根据用水稀释浓溶液成稀溶液的过程中,溶质的质量不变,稀溶液与浓溶液质量之差就是加入水的质量;
(2)根据20g稀硫酸中溶质的质量可以求出,因此根据硫酸的质量就可以求出生成的氢气的质量.
解答 解:(1)设将10g浓硫酸稀释成19.6%的稀硫酸需要加入的水的质量为y
根据稀释前后溶质的质量不变可得
10g×98%=19.6%(10g+y)
y=40g
(2)20g稀硫酸中溶质的质量为:20g×19.6%=3.92g
设生成氢气的质量为x
Zn+H2SO4=ZnSO4+H2↑
98 2
3.92g x
$\frac{98}{3.92g}$=$\frac{2}{x}$
x=0.08g
答:(1)将10g浓硫酸配制成所需的稀硫酸,需要水的质量为40g;
(2)生成氢气的质量是0.08g.
故答案为:(1)40g;
(2)0.08g.
点评 本题难度不是很大,主要考查了有关溶质质量分数的计算及根据化学方程式进行有关量的计算,培养学生的计算能力和应用知识分析问题、解决问题的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.取4份等质量的KClO3,向其中3份中分别加入少量等质量的KMnO4、MnO2和Mn,分别在某温度下加热至质量不再改变,测定收集到的氧气质量.然后将剩余固体溶于足量水中,添加过物质的组别中均有相同组成的不溶物.测定结果如下:
已知本题中各反应前后所涉及的含钾元素的化合物均可溶于水.下列说法一定正确的是( )
| 组别 | ① | ② | ③ | ④ |
| 加入物质 | 无 | KMnO4 | MnO2 | Mn |
| 收集到的氧气质量/g | 0 | m1 | m2 | m3 |
| 不溶物的质量/g | 0 | w1 | w2 | w3 |
| A. | 不加入其他物质时,KClO3不能发生分解反应 | |
| B. | KMnO4是KClO3分解制氧气效果最好的催化剂 | |
| C. | 产生氧气的质量关系为m1>m2=m3 | |
| D. | 残留不溶物的质量关系为w1<w2<w3 |
1.中国药学家屠呦呦因创新型抗疟药青高素和双氢青蒿素的贡献,荣获2015年度诺贝尔生理医学奖.青高素化学式为C15H22O5.下列关于青蒿素的说法正确的是( )
| A. | 组成元素中,氧元素的质量分数最小, | |
| B. | 含有氧元素,是氧化物 | |
| C. | 含有碳元素,是有机物 | |
| D. | 碳元素与氢元素的质量比为15:22 |
18.为探究氢氧化钙溶液和稀盐酸反应后所得溶液中溶质的成分,同学们通过测定反应后溶液的PH,得到了如图1所示的PH曲线,请回答下列问题.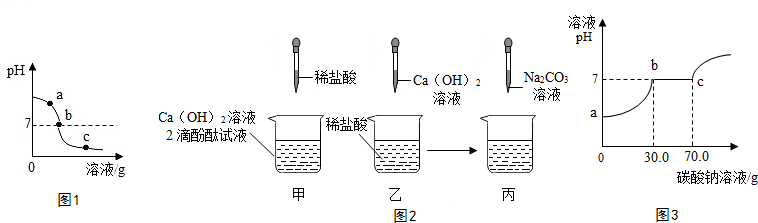
(1)由图1可知该实验操作是将稀盐酸滴加到另一种溶液中;
(2)该反应的化学方程式为Ca(OH)2+2HCl═CaCl2+2H2O;
(3)实验过程中,取a、b、c三处反应后的溶液于三个烧杯中,但是忘了做标记,同学们通过设计方案(不再用测定pH的方法),探究三种样品分别属于哪处溶液.
【查阅资料】CaCl2溶液显中性,CaCl2+Na2CO3═CaCO3↓+2NaCl.
【探究过程】
①分别取少量样品于三支试管中,加入酚酞试液,观察到其中一支试管内出现溶液由无色变成红色的现象.结论:该样品是a处溶液.
②为进一步确定b或c处溶液,又设计了如表方案:
(4)如图2,同学们做甲、乙、两个中和反应实验的探究.
①甲实验恰好中和,则该溶液中的溶质是CaCl2(化学式).
②取乙反应后的溶液60.0g,滴加质量分数26.5%的Na2CO3溶液,如图2丙,溶液pH的变化如图3,请计算该溶液中CaCl2的溶质质量分数18.5%(写出计算过程,精确到0.1%).

(1)由图1可知该实验操作是将稀盐酸滴加到另一种溶液中;
(2)该反应的化学方程式为Ca(OH)2+2HCl═CaCl2+2H2O;
(3)实验过程中,取a、b、c三处反应后的溶液于三个烧杯中,但是忘了做标记,同学们通过设计方案(不再用测定pH的方法),探究三种样品分别属于哪处溶液.
【查阅资料】CaCl2溶液显中性,CaCl2+Na2CO3═CaCO3↓+2NaCl.
【探究过程】
①分别取少量样品于三支试管中,加入酚酞试液,观察到其中一支试管内出现溶液由无色变成红色的现象.结论:该样品是a处溶液.
②为进一步确定b或c处溶液,又设计了如表方案:
| 实验步骤 | 实验现象 | 实验结论 |
| 另取余下样品少量于两支试管中,分别滴加足量的Na2CO3溶液. | 只产生白色沉淀 | 该样品为b处溶液. |
| 先产生气泡,后产生白色沉淀 | 该样品为c处溶液,并推知溶液中的阳离子有Ca2+、H+. |
①甲实验恰好中和,则该溶液中的溶质是CaCl2(化学式).
②取乙反应后的溶液60.0g,滴加质量分数26.5%的Na2CO3溶液,如图2丙,溶液pH的变化如图3,请计算该溶液中CaCl2的溶质质量分数18.5%(写出计算过程,精确到0.1%).
5.物质的变化需要在一定条件下进行,通过控制反应条件可以控制化学反应的快慢.下列做法是为了减慢化学反应的是( )
| A. | 用较浓的食醋除水垢 | |
| B. | 实验室制取氧气时用二氧化锰做催化剂 | |
| C. | 将食物放入冰箱中保存 | |
| D. | 烧煤时煤块粉碎成煤粉 |
19.下列过程中发生化学变化的是( )
| A. |  石油分馏 | B. |  灯泡通电发光 | C. |  湿衣服晾干 | D. |  |
 小宁和小明同学学习完酸、碱、盐后发现:碱溶液能使酚酞试液变红,Na2CO3溶液也能使酚酞试液变红.碱溶液使酚酞试液变红是因为碱在水中解离出OH-,那么Na2CO3溶液中究竟是哪种粒子使酚酞试液变红的呢?小宁设计了如图所示三个实验,请你、小宁和小明一起探究并完成下列问题:
小宁和小明同学学习完酸、碱、盐后发现:碱溶液能使酚酞试液变红,Na2CO3溶液也能使酚酞试液变红.碱溶液使酚酞试液变红是因为碱在水中解离出OH-,那么Na2CO3溶液中究竟是哪种粒子使酚酞试液变红的呢?小宁设计了如图所示三个实验,请你、小宁和小明一起探究并完成下列问题: