题目内容
7.冬季取暖人们常用到暖宝宝(图3),其热量来源于铁的缓慢氧化.化学小组的同学突发奇想,想利用暖宝宝测定空气中氧气的含量.查阅资料:(1)暖宝宝的主要成分铁粉、木炭、食盐.
(2)暖宝宝反应的主要原理是铁粉与氧气、水共同作
用生成氢氧化铁,反应的化学方程式为4Fe+3O2+6H2O═4Fe(OH)3.
设计实验:化学小组的同学设计了图1所示装置.实验步骤如下:

①检查装置气密性
②向250mL集气瓶中加入20mL水
③读取温度计示数为18°C,撕掉暖宝宝上的贴纸,塞紧橡胶塞.
④观察温度计示数的变化
⑤待温度计示数为18°C时,打开止水夹.
回答下列问题:
(1)检查装置气密性的方法是连接好装置,把导管的一端放入水中,用手紧握试管,观察水中导管口有没有气泡冒出,如果有气泡冒出,说明装置不漏气.
(2)小组同学的设计中,集气瓶内水的作用是铁粉生锈提供水分.
(3)实验结果如图2所示,则小组同学得出的结论是氧气约占空气体积的$\frac{1}{5}$.
实验反思:反思实验过程,你认为小组同学实验产生误差的可能原因有发热剂没有完全生锈(写出一条即可).你证明这确实是造成误差原因的方案是向发热剂中加入盐酸,如果有气泡生成,则说明有铁粉.
分析 根据反应原理写出反应的化学方程式解答;
(1)根据检查装置气密性的方法进行分析解答;
(2)根据集气瓶内水的作用是为铁丝生锈提供水分解答;
(3)根据氧气约占空气体积的$\frac{1}{5}$解答;
根据保证本实验成功的关键是:①装置气密性好;②铁粉要足量;③要冷却至室温再读数等,结合红磷测定氧气的原理分析即可.
解答 解:暖宝宝中含有铁粉、活性炭、水、氯化钠等物质,遇空气发生反应的化学方程式是:4Fe+3O2+6H2O═4Fe(OH)3
(1)检查置气密性的方法是:连接好装置,把导管的一端放入水中,用手紧握试管,观察水中导管口有没有气泡冒出,如果有气泡冒出,说明装置不漏气.
(2)小组同学的设计中,集气瓶内水的作用是为铁粉生锈提供水分;
(3)根据反应前后烧杯内水的体积变化可以看出,消耗的氧气的体积是:100mL-60mL=40mL,故氧气的体积分数为:$\frac{40ml}{250mL-20mL}×$100%,即氧气约占空气体积的$\frac{1}{5}$;
实验反思:反思实验过程,你认为小组同学实验产生误差的可能原因有装置漏气,会使进入的水偏少,测定的结果偏小;发热剂没有完全生锈,没有将氧气耗尽;向发热剂中加入盐酸,如果有气泡生成,则说明有铁粉.
答案:4Fe+3O2+6H2O═4Fe(OH)3;
(1)连接好装置,把导管的一端放入水中,用手紧握试管,观察水中导管口有没有气泡冒出,如果有气泡冒出,说明装置不漏气.
(2)铁粉生锈提供水分;
(3)氧气约占空气体积的$\frac{1}{5}$;
发热剂没有完全生锈;向发热剂中加入盐酸,如果有气泡生成,则说明有铁粉.
点评 本题考查了实验步骤的设计,还对实验进行了评价,综合性比较强.实验设计题是近几年中考的重要考点之一,希望同学们前后联系,认真掌握.

| A. | O2 | B. | 2H | C. | F e | D. | H2O |
| A. | 3O--3个氧原子 | B. | CO2--1个二氧化碳分子 | ||
| C. | O2--2个氧原子 | D. | Fe+3--带3个单位正电荷的铁原子 |
 已知A、B、C、D、E、F是初中化学中常见的六种物质,其中A为-一种常见的酸,B、C、D为氧化物,E为单质且粉末为黑色,F常用于建筑材料.它们之间在一定条件下有如图所示的转化关系(图中“→”表示物质间存在转化关系,“一”表示两种物质间能发生反应,部分反应物和生成物已略去).请按要求回答下列问题:
已知A、B、C、D、E、F是初中化学中常见的六种物质,其中A为-一种常见的酸,B、C、D为氧化物,E为单质且粉末为黑色,F常用于建筑材料.它们之间在一定条件下有如图所示的转化关系(图中“→”表示物质间存在转化关系,“一”表示两种物质间能发生反应,部分反应物和生成物已略去).请按要求回答下列问题: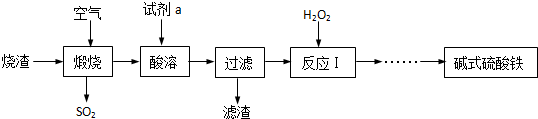

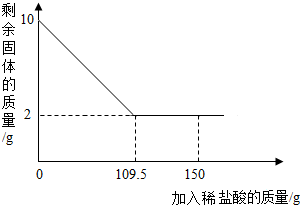 有一赤铁矿样品(主要成分为氧化铁),某学校化学兴趣小组为了测得样品中氧化铁的质量分数,进行了如下探究:小明取10g赤铁矿样品(杂质不溶于水和酸),不断加入稀盐酸到固体的质量不再减少,加入稀盐酸的量如图所示:求:
有一赤铁矿样品(主要成分为氧化铁),某学校化学兴趣小组为了测得样品中氧化铁的质量分数,进行了如下探究:小明取10g赤铁矿样品(杂质不溶于水和酸),不断加入稀盐酸到固体的质量不再减少,加入稀盐酸的量如图所示:求: