题目内容
15.某兴趣小组利用硫酸厂的烧渣(主要成分为:铁的氧化物、少量FeS及SiO2),在实验室制备碱式硫酸铁[化学式为Fex(OH)y(SO4)z•nH2O],主要流程如下: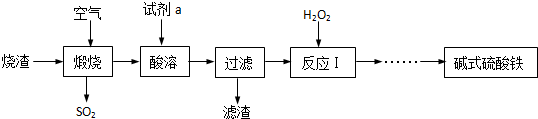
(1)焙烧时产生的二氧化硫可用石灰乳吸收,发生反应的化学方程式为Ca(OH)2+SO2═CaSO3↓+H2O,该步骤中用石灰乳而不用澄清石灰水的原因是石灰乳中的氢氧化钙含量高,能够吸收更多的二氧化硫.
(2)酸溶时加入的试剂a是H2SO4(填化学式),酸溶时发生的反应属于复分解反应(填基本反应类型).过滤后获得的滤渣的主要成分是SiO2.
(3)反应l中加双氧水的目的是为了将溶液中的Fe2+氧化为Fe3+(填离子符号).双氧水作为该反应氧化剂的优点是产物不污染环境.
(4)流程中获得碱式硫酸铁[化学式为Fex(OH)y(SO4)z•nH2O]前省略的操作是蒸发﹑冷却结晶﹑洗涤和低温烘干.
(5)为确定碱式硫酸铁的化学式,进行了如下实验:
①称取1.692g碱式硫酸铁样品溶于足量的稀盐酸中并充分混合;
②向①所得的混合物中加入足量的BaCl2溶液,充分反应后,经过滤、洗涤、干燥、
称重,得沉淀2.330g.
③若向步骤②的滤液中加入过量的NaOH溶液,充分反应后,再将沉淀过滤、洗涤、灼烧、称重,得固体0.640g.则碱式硫酸铁[Fex(OH)y(SO4)z•nH2O]样品中的y:z的值为12:5.
分析 (1)石灰乳中的氢氧化钙能和二氧化硫反应生成亚硫酸钙沉淀和水;
氢氧化钙的溶解度较小;
(2)酸溶时加入的试剂a是硫酸;
二氧化硅不能和稀硫酸反应;
(3)反应l中加双氧水的目的是为了将溶液中的Fe2+氧化为铁离子;
双氧水作为该反应氧化剂的优点是产物不污染环境;
(4)流程中获得碱式硫酸铁[化学式为Fex(OH)y(SO4)z•nH2O]前省略的操作是 蒸发蒸发﹑冷却结晶﹑洗涤和低温烘干;
(5)根据反应情况和提供的数据可以进行相关方面的计算.
解答 解:(1)焙烧时产生的二氧化硫可用石灰乳吸收,发生反应的化学方程式为:Ca(OH)2+SO2═CaSO3↓+H2O,该步骤中用石灰乳而不用澄清石灰水的原因是石灰乳中的氢氧化钙含量高,能够吸收更多的二氧化硫.
故填:Ca(OH)2+SO2═CaSO3↓+H2O;石灰乳中的氢氧化钙含量高,能够吸收更多的二氧化硫.
(2)酸溶时加入的试剂a是H2SO4,酸溶时发生反应的属于复分解反应,过滤后获得的滤渣的主要成分是SiO2.
故填:H2SO4;复分解;SiO2.
(3)反应l中加双氧水的目的是为了将溶液中的Fe2+氧化为Fe3+;
双氧水作为该反应氧化剂的优点是产物是水和氧气,不污染环境.
故填:Fe3+;产物不污染环境.
(4)流程中获得碱式硫酸铁[化学式为Fex(OH)y(SO4)z•nH2O]前省略的操作是蒸发﹑冷却结晶﹑洗涤和低温烘干.
故填:蒸发;洗涤.
(5)②向①所得的混合物中加入足量的BaCl2溶液,充分反应后,经过滤、洗涤、干燥、称重,得沉淀2.330g,沉淀是硫酸钡,2.330g硫酸钡中硫酸根离子的质量为:
2.330g×$\frac{96}{233}$×100%=0.96g,
③若向步骤②的滤液中加入过量的NaOH溶液,氢氧根离子和铁离子结合成氢氧化铁沉淀,充分反应后,再将沉淀过滤、洗涤、灼烧、称重,得固体0.640g,灼烧氢氧化铁时,氢氧化铁分解生成水和氧化铁,即氧化铁的质量是0.640g,
设氢氧化铁质量为x,
2Fe(OH)3$\frac{\underline{\;高温\;}}{\;}$Fe2O3+3H2O,
214 160
x 0.640g
$\frac{214}{x}$=$\frac{160}{0.640g}$,
x=0.856g,
0.856g氢氧化铁中氢氧根离子质量为:0.856g×$\frac{51}{107}$×100%=0.408g,
根据题意有:$\frac{17y}{96z}$=$\frac{0.408g}{0.96g}$,
$\frac{y}{z}$=$\frac{12}{5}$,
故填:12:5.
点评 本题主要考查物质的性质,只有掌握了各种物质的性质,才能够判断物质之间相互转化时的反应物和生成物,从而可以进行各方面的判断.

| A. | 银 | B. | 铅 | C. | 铜 | D. | 锌 |
| A. |  | B. |  硫元素化合价 硫元素化合价 | ||
| C. |  | D. |  金属活动性 金属活动性 |
| A. | 生成盐和水的反应都是中和反应;用烧碱可以改良酸性土壤 | |
| B. | 服用氢氧化钠治疗胃酸过多;干电池可以将电能转化为化学能 | |
| C. | 维生素不能提供能量所以对人体用处不大;硒是人体必须的微量元素,应大量服用 | |
| D. | 使用新能源,能减少酸雨产生;误食重金属盐,可立即服用蛋清或牛奶解毒 |
 如图a、b两种固体物质的溶解度曲线.
如图a、b两种固体物质的溶解度曲线.
