题目内容
11.某物质在氧气中完全燃烧,生成二氧化碳和水的质量比为22:9,则该物质不可能是( )| A. | C2H4 | B. | C2H4O | C. | C6H12O6 | D. | C12H22O11 |
分析 根据质量守恒定律可以知道,反应前后元素的质量不变,所以可以根据化学反应前后碳元素和氢元素的质量相等来计算即:二氧化碳的质量乘以二氧化碳中碳元素的质量分数,再除以碳元素的相对原子质量,就可以表示二氧化碳中碳原子的个数,同样可以表示水中氢原子的个数;两者相比得到碳原子和氢原子的个数比,根据质量守恒定律可知这个比就是该有机物中碳、氢元素的原子个数比,并作出判断即可.
解答 解:根据二氧化碳和水的质量比为22:9,所以可以求算出碳元素和氢元素的质量比为:(22×$\frac{12}{44}$):(9×$\frac{2}{18}$)=6:1,则该化合物中碳、氢的原子个数比是$\frac{\frac{6}{12}}{\frac{1}{1}}$=1:2,分析题给的四种化合物不满足该条件的为D.
故选D.
点评 本题主要考查有关化学式的计算,难度不大,关键是要学会由物质质量求原子个数比的方法.

练习册系列答案
相关题目
1.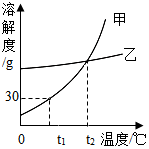 如图是甲、乙两种固体物质的溶解度曲线,下列说法正确的是( )
如图是甲、乙两种固体物质的溶解度曲线,下列说法正确的是( )
 如图是甲、乙两种固体物质的溶解度曲线,下列说法正确的是( )
如图是甲、乙两种固体物质的溶解度曲线,下列说法正确的是( )| A. | t2℃时甲的饱和溶液降温至t1℃变为不饱和溶液 | |
| B. | t1℃时,50g甲的饱和溶液中有15g甲 | |
| C. | t2℃时,甲、乙两物质溶液中溶质的质量分数相等 | |
| D. | 当甲中含有少量乙时,可以用降温结晶的方法提纯甲 |
2.下列说法不正确的是( )
| A. | 原子是化学变化中的最小粒子 | |
| B. | 保持水的化学性质的最小微粒是氢原子和氧原子 | |
| C. | 原子的质量主要集中在原子核上 | |
| D. | 分子、原子、离子都可以直接构成物质 |
6.下列实验操作或对实验现象的描述正确的是( )
| A. | 在量筒中稀释浓硫酸,配制100g5%的硫酸溶液 | |
| B. | 蒸发食盐水时,将蒸发皿中水分蒸干后停止加热 | |
| C. | 常温下,用20gCa(OH)2配制25%的澄清石灰水 | |
| D. | 用小鹅石、细沙、活性炭的简易过滤装置可除去水中不溶性固体、异味和色素 |

 图是 A、B、C三种物质的溶解度曲线,回答下列问题:
图是 A、B、C三种物质的溶解度曲线,回答下列问题: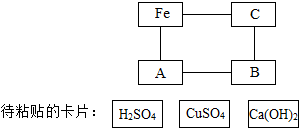 图是化学园地中一张表示物质间反应关系的卡片图(“--”表示相连的两种物质能够在溶液体系中发生化学反应),其中A、B、C三处的卡片尚未粘贴.
图是化学园地中一张表示物质间反应关系的卡片图(“--”表示相连的两种物质能够在溶液体系中发生化学反应),其中A、B、C三处的卡片尚未粘贴.
