题目内容
11. 甲、乙两个化学兴趣小组的同学为测定某地石灰石的质量分数(杂质不参与反应),分别设计方案并进行实验.
甲、乙两个化学兴趣小组的同学为测定某地石灰石的质量分数(杂质不参与反应),分别设计方案并进行实验.甲组:实验:取石灰石样品10.00g,高温煅烧至质量不再改变后,把剩余的固体放在密闭、干燥的容器中冷却至室温,称量所得固体的质量为6.04g.请你写出正确的计算过程.
乙组:也取原石灰石样品10.00g,按图所示装置(气密性完好)进行实验,测得完全反应后氢氧化钠溶液增重了3.90g.由此计算出碳酸钙的质量分数.
甲组同学认为乙组同学的计算结果不可靠,其理由是锥形瓶中含有残留的二氧化碳,导致有部分二氧化碳没有被氢氧化钠溶液吸收.
分析 甲组:根据固体质量的减少量是二氧化碳的质量,再根据方程式进行计算即可;
乙组:根据锥形瓶中含有残留的二氧化碳分析.
解答 解:甲组:根据质量守恒定律可知固体质量的减少量属于生成的二氧化碳的质量,所以生成二氧化碳的质量为:10g-6.04g=3.96g,设要生成3.96g二氧化碳需要碳酸钙的质量为x:
CaCO3 $\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑
100 44
x 3.96g
$\frac{100}{x}$=$\frac{44}{3.96g}$
解得x=9g
碳酸钙的质量分数为:$\frac{9g}{10g}$×100%=90%
答:碳酸钙的质量分数为90%.
乙组:根据C中氢氧化钠溶液增加的质量属于二氧化碳的质量,锥形瓶中含有残留的二氧化碳,导致有部分二氧化碳没有被氢氧化钠溶液吸收,计算出来的碳酸钙质量就会偏小.
故答案为:锥形瓶中含有残留的二氧化碳,导致有部分二氧化碳没有被氢氧化钠溶液吸收.
点评 解决本题的关键要看固体质量的减少量属于生成气体的质量,用盐酸制取二氧化碳时会混有氯化氢气体,需要将其除去,才会减少误差.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
2.草木灰的主要成分是碳酸钾(K2CO3),下列关于草木灰的说法中错误的是( )
| A. | 可作钾肥 | B. | 由三种元素组成 | ||
| C. | K2CO3属于盐类 | D. | 碳元素的化合价是+2价 |
16.人体缺少必需的微量元素会影响健康,甲状腺肿大通常需要补充的元素是( )
| A. | 铁 | B. | 钙 | C. | 氟 | D. | 碘 |
3.同种元素的原子和离子一定相同的是( )
| A. | 质子数 | B. | 电子数 | C. | 最外层电子数 | D. | 电子层数 |
 金属材料与人类的生产和生活密切相关.
金属材料与人类的生产和生活密切相关.
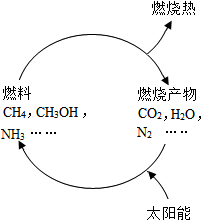 (1)从能源是否可以循环再生的角度看,可以将能源分为可再生能源和不可再生能源,譬如煤、石油、天然气就是不可再生能源.日益严峻的能源危机促进了可再生能源的研究.有专家提出:如果能够利用太阳能使燃料燃烧产物,如CO2、H2O、N2等重新组合(如图),可以节约燃料,缓解能源危机.在此构想的物质循环中太阳能最终转化为热能.
(1)从能源是否可以循环再生的角度看,可以将能源分为可再生能源和不可再生能源,譬如煤、石油、天然气就是不可再生能源.日益严峻的能源危机促进了可再生能源的研究.有专家提出:如果能够利用太阳能使燃料燃烧产物,如CO2、H2O、N2等重新组合(如图),可以节约燃料,缓解能源危机.在此构想的物质循环中太阳能最终转化为热能.