题目内容
1.为测定石灰石样品中碳酸钙的含量,小明取25g石灰石样品与-定质量的7.3%的稀盐酸恰好完全反应,将反应所得混合物蒸干得到固体27.2g(不含结晶水,假设样品中的杂质既不与稀盐酸反应也不溶于水).试计算:(1)参加反应的盐酸的质量.
(2)石灰石样品中碳酸钙的含量.
(3)上述反应所得滤液中溶质的质量分数.
分析 碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,根据反应前的固体质量差可以计算氯化氢的质量、碳酸钙的质量、氯化钙的质量和二氧化碳的质量,进一步可以计算石灰石样品中碳酸钙的含量和上述反应所得滤液中溶质的质量分数.
解答 解:(1)设参加反应的碳酸钙的质量为X,参加反应的盐酸的溶质的质量为Y,反应生成氯化钙的质量为Z,生成二氧化碳的质量为M,
反应前后固体质量之差为27.2g-25g=2.2g,
CaCO3+2HCl═CaCl2+H2O+CO2↑,反应前后固体的质量差
100 73 111 44 111-100=11
X Y Z M 2.2g
$\frac{100}{X}$=$\frac{73}{Y}$=$\frac{111}{Z}$=$\frac{44}{M}$=$\frac{11}{2.2g}$,
解之得:X=20g,Y=14.6g,Z=22.2g,M=8.8g,
参加反应的盐酸的质量为:$\frac{14.6g}{7.3%}$=200g,
答:反应的盐酸的质量为200g.
(2)石灰石样品中碳酸钙的含量为:$\frac{20g}{25g}$×100%=80%,
答:石灰石样品中碳酸钙的含量为80%.
(3)反应后所得溶液为氯化钙溶液,溶液质量=20g+200g-8.8g=211.2g,
所得溶液溶质的质量分数为$\frac{22.2g}{211.2g}$×100%=10.5%,
答:所得溶液溶质的质量分数为10.5%.
点评 差量法在计算中的应用很广泛,解答的关键是要分析出物质的质量差与要求的未知数之间的关系,再根据具体的数据求解.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
9.下表中“-”表示相连的物质间能发生反应,“→”表示这种物质可转化为另一种物质.甲、乙、丙、丁四种物质不符合对应“转化关系”的是( )
| 选项 | A | B | C | D | |
| 转化关系 |  |  |  |  | |
| 物质 | 甲 | C | Na2CO3 | Ca(OH)2 | Fe |
| 乙 | O2 | Ca(OH)2 | HCl | HCl | |
| 丙 | CuO | NaCl | CO2 | CuCl2 | |
| 丁 | CO | H2SO4 | NaOH | NaOH | |
| A. | A | B. | B | C. | C | D. | D |
6. 某同学用含有不同种类酶的洗衣液和如图装置进行了如下实验.请回答:
某同学用含有不同种类酶的洗衣液和如图装置进行了如下实验.请回答:
(1)该实验中甲与乙、甲与丙分别构成两组对照实验,则实验目的是探究酶的专一性.
(2)除温度外,影响实验结果的其他变量还有洗衣粉的用量、衣服的污染程度(请写出2个).
(3)该同学在实验过程中可通过观察蛋白膜消失的时间长短来判断酶的催化效率.
(4)含蛋白酶的洗衣液不能用于洗涤丝质及羊毛衣料,其主要原因是蛋白酶能促进蛋白质的分解.
 某同学用含有不同种类酶的洗衣液和如图装置进行了如下实验.请回答:
某同学用含有不同种类酶的洗衣液和如图装置进行了如下实验.请回答:| 组别 | 洗衣液 | 胶片规格 | 污染物 | 水温 |
| 甲 | 含蛋白酶的洗衣液 | 6cm×6cm | 蛋白质膜 | 37℃ |
| 乙 | 含脂肪酶的洗衣液 | 6cm×6cm | 蛋白质膜 | 37℃ |
| 丙 | 含蛋白酶的洗衣液 | 6cm×6cm | 淀粉膜 | 37℃ |
(2)除温度外,影响实验结果的其他变量还有洗衣粉的用量、衣服的污染程度(请写出2个).
(3)该同学在实验过程中可通过观察蛋白膜消失的时间长短来判断酶的催化效率.
(4)含蛋白酶的洗衣液不能用于洗涤丝质及羊毛衣料,其主要原因是蛋白酶能促进蛋白质的分解.
13.下面是某同学在实验时记录的实验现象,其中与事实不相符的是( )
| A. | 在纯碱溶液中滴加几滴石蕊试液,溶液呈红色 | |
| B. | 在稀硫酸中加入铁粉,溶液逐渐变成浅绿色 | |
| C. | 加热饱和石灰水,出现白色浑浊 | |
| D. | 在氢氧化钠溶液中滴加硫酸铜溶液,出现蓝色沉淀 |
10.电子业、工业、轨道交通等的发展,使重庆正在走向一个更新、更高的台阶.而修建地铁所用的主要材料之一是锰钢.锰钢属于( )
| A. | 合成材料 | B. | 金属材料 | C. | 纯净物 | D. | 有机物 |
7.在气焊、炼钢、医疗、登山等生产、生活中,都离不了的一种气体是( )
| A. | 水蒸气 | B. | 氧气 | C. | 氮气 | D. | 二氧化碳 |
 甲、乙两个化学兴趣小组的同学为测定某地石灰石的质量分数(杂质不参与反应),分别设计方案并进行实验.
甲、乙两个化学兴趣小组的同学为测定某地石灰石的质量分数(杂质不参与反应),分别设计方案并进行实验.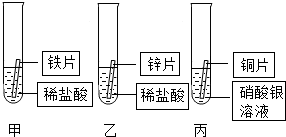 某研究小组的同学为探究铁、铜、锌、银的金属活动性顺序,设计如图所示的三个实验(其中金属均已用砂纸打磨,且形状、大小相同;所用稀盐酸的溶质质量分数、用量也相同).
某研究小组的同学为探究铁、铜、锌、银的金属活动性顺序,设计如图所示的三个实验(其中金属均已用砂纸打磨,且形状、大小相同;所用稀盐酸的溶质质量分数、用量也相同).