题目内容
17.如图为实验室常用的实验装置.回答问题:
(1)标号仪器的名称:①分液漏斗;②集气瓶.
(2)做铁丝在氧气中燃烧实验时应选择的收集装置是F.
(3)用B、D组合制取气体的化学反应方程式CaCO3+2HCl=CaCl2+H2O+CO2↑.若将发生装置由B改为C,其优点是可随时控制反应的发生和停止.
(4)硫化氢气体(H2S)有毒,溶于水形成酸.用块状硫化亚铁(FeS)和稀硫酸发生复分解反应制得H2S,反应化学方程式为FeS+H2SO4=FeSO4+H2S↑.某同学用上图G、H、I组合收集H2S.
①用G收集H2S,说明其密度比空气大(填“大”或“小”).
②各装置的作用:H防止液体倒吸入G中、I吸收多余的H2S,预防H2S污染大气.
分析 (1)据常用仪器回答;
(2)排水法收集的氧气较纯净,同时集气瓶底便于留少量的水;
(3)B装置是固液常温型,D收集密度比空气大的气体;实验室通常用大理石或石灰石和稀盐酸反应制取二氧化碳,反应不需要加热,大理石和石灰石的主要成分是碳酸钙,能和稀盐酸反应生成氯化钙、水和二氧化碳,二氧化碳的密度比空气大,所以制取二氧化碳可用该套装置;C装置具有可随时控制反应的发生和停止的优点;
(4)①根据收集气体的装置可以比较气体与空气密度的大小;
②不同的实验装置,功能不同,据装置特点分析解答.
解答 解:(1)标号仪器分别是分液漏斗和集气瓶.
(2)排水法收集的氧气较纯净,同时集气瓶底便于留少量的水,适合做铁丝在氧气中燃烧实验;
(3)用B、D组合可以制取二氧化碳,大理石和石灰石的主要成分是碳酸钙,能和稀盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式是:CaCO3+2HCl=CaCl2+H2O+CO2↑;若将发生装置由B改为C,其优点是可通过活塞开闭随时控制反应的进行或停止;
(4)硫化亚铁(FeS)和稀硫酸发生复分解反应生成硫酸亚铁和硫化氢气体,反应化学方程式为:FeS+H2SO4=FeSO4+H2S↑;
①可以利用G装置收集H2S,该装置是长管进气,通过短管排空气,说明其密度比空气大;
②H装置的作用是防止液体倒吸入G中;I装置的作用是吸收多余的H2S,预防H2S污染大气.
故答案为:(1)分液漏斗; 集气瓶;
(2)F;
(3)CaCO3+2HCl=CaCl2+H20+CO2↑ (其他合理也给分);可随时控制反应的发生和停止
(4)FeS+H2SO4=H2S↑+FeSO4; 大; 防止液体倒吸入G中; 吸收多余的H2S,预防H2S污染大气.
点评 本题综合考查了学生的基本实验能力,涉及仪器的用途、化学方程式的书写、装置选择、装置的作用等知识,只有综合理解化学知识才能够正确的解答.

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案 资料显示:镁与饱和碳酸氢钠溶液反应会产生大量气体和白色不溶物.某同学设计了如下实验方案,探究分析反应的产物.
资料显示:镁与饱和碳酸氢钠溶液反应会产生大量气体和白色不溶物.某同学设计了如下实验方案,探究分析反应的产物.查阅资料知:①MgCO3和Mg(OH)2均为白色不溶物.
②酚酞遇碳酸氢钠溶液呈浅红色,酚酞遇碳酸钠溶液呈红色.
(1)提出假设:
实验I:用砂纸擦去镁条表面氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红色变成了红色.
该同学对反应中产生的白色不溶物做出如下猜测:
猜测1:白色不溶物可能是MgCO3
猜测2:白色不溶物可能是Mg(OH)2
猜测3:白色不溶物可能是MgCO3和Mg(OH)2.
(2)设计实验确定产物并验证猜测:
| 实验序号 | 实验操作 | 实验现象 | 结论 |
| 实验Ⅱ | 将实验I中收集到的气体点燃 | 能安静燃烧、产生淡蓝色火焰 | 气体为H2 |
| 实验Ⅲ | 取实验I中少量的白色不溶物,加入足量的稀盐酸 | 产生大量气泡 | 白色不溶物含有MgCO3 |
| 实验Ⅳ | 取实验I中的澄清液,向其中加入少量CaCl2稀溶液 | 产生白色沉淀 | 澄清液中含有的溶质是碳酸钠(Na2CO3) |
已知:MgCO3$\frac{\underline{\;\;△\;\;}}{\;}$MgO+CO2↑
Mg(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$MgO+H2O
碱石灰可以吸收二氧化碳和水蒸气
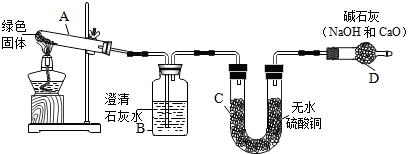
①如图所示的实验装置C中碱石灰的作用是阻止空气中二氧化碳和水进入B中.
②称取实验Ⅰ中所得的干燥纯净的白色不溶物22.6g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中.实验前后装置A增重1.8g,装置B增重8.8g,请分析数据并结合实验Ⅱ、Ⅲ、Ⅳ的结论,该白色不溶物除含碳酸镁外还含有氢氧化镁Mg(OH)2,它们的质量比为84:29.
| A. | 用甲醛溶液浸泡海鲜品 | B. | 用工业盐腌制咸鱼腊肉 | ||
| C. | 牛奶经发酵后得到酸奶 | D. | 用聚氯乙烯塑料袋包装食品 |
| A. | 不溶物中一定有铜 | B. | 不溶物可能全部是铁 | ||
| C. | 滤液是硫酸亚铁溶液 | D. | 滤液中含有硫酸铜和硫酸亚铁 |
【提出问题】镁是否能与水反应?
【作出假设】(1)镁不能与水反应生成碱和氢气;(2)镁能与水反应生成碱和氢气.
【实验探究】在两个烧杯中,分别加入等量的冷水和镁条,用酚酞作指示剂,实验过程和现象如图:

小丁除了用酚酞溶液测定溶液显碱性,还用pH试纸测定溶液显碱性的强弱,他用水浸湿pH试纸后再进行测定,这样测得的结果比实际值偏小(填“大”或“小”).
【反思与总结】
(1)通过实验能得出的结论是镁不能与冷水反应,能与热水反应;
(2)小丁发现B试管放置在空气中一会儿,溶液的红色会褪色,这说明溶液的碱性减弱了,于是他大胆作出了一个猜想,并设计了验证方案:
| 猜想 | 验证方案 |
| 可能是氢氧化镁的溶解度受温度的影响,温度降低,溶解度变小,从而导致溶液碱性减弱 | 将褪色后的溶液加热,如果溶液变红,说明小丁的猜想正确 |
(3)综上实验,写出镁条与水之间反应的化学方程式Mg+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+H2↑.此反应的基本类型是置换反应.
| 温度(℃) | 0 | 10 | 20 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| KNO3 | 13.3 | 20.9 | 32 | 64 | 85.5 | 110 | 138 | 169 | 202 | 246 |
| NaCl | 35.7 | 35.8 | 36 | 36.6 | 37 | 37.3 | 37.8 | 38.4 | 39 | 39.8 |
(2)KNO3溶液中含有少量NaCl时,可通过降温结晶的方法提纯.析出的晶体和剩余溶液描述正确的是①(填写编号).
①剩余溶液一定是KNO3饱和溶液 ②剩余溶液一定是NaCl饱和溶液
③上述方法可以将两者完全分离 ④析出的晶体中不一定含有KNO3
(3)KNO3、NaCl在t℃时溶解度均为W克,则t的最可能范围是A
A.20<t<30 B.t=30 C.30<t<40 D.无法确定.