题目内容
17.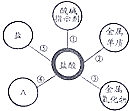 小丽在复习硫酸和盐酸的性质时归纳出,硫酸和盐酸的五条化学性质(如右图所示,连线表示相互反应).
小丽在复习硫酸和盐酸的性质时归纳出,硫酸和盐酸的五条化学性质(如右图所示,连线表示相互反应).(1)为了验证性质①,小丽将紫色石蕊试液滴加到稀硫酸和盐酸溶液中,溶液都变红色;
(2)它们都能除铁锈,写出盐酸与铁锈主要成分反应的化学方程式Fe2O3+6HCl=2FeCl3+3H2O;
(3)打开两瓶分别盛有浓硫酸和浓盐酸的试剂瓶,瓶口出现白雾的是浓盐酸;
(4)请写出把硫酸转变为盐酸的化学方程式BaCl3+H2SO4=BaSO4+2HCl;
(5)为了验证性质⑤,可选用的两种物质是HCl和Na2CO3.
分析 (1)显酸性的溶液能使石蕊试液表示;
(2)铁锈的主要成分是氧化铁,氧化铁和稀盐酸反应生成氯化铁和水;
(3)浓硫酸具有吸水性,浓盐酸具有挥发性;
(4)氯化钡和稀硫酸反应生成硫酸钡沉淀和盐酸;
(5)碳酸钠属于盐,能和稀盐酸反应生成氯化钠、水和二氧化碳,能和稀硫酸反应生成硫酸钠、水和二氧化碳.
解答 解:(1)为了验证性质①,将紫色石蕊试液滴加到稀硫酸和盐酸溶液中,溶液都变红色;
(2)盐酸与铁锈主要成分反应的化学方程式为:Fe2O3+6HCl═2FeCl3+3H2O;
(3)打开两瓶分别盛有浓硫酸和浓盐酸的试剂瓶时,盛有浓硫酸的试剂瓶无明显现象,盛有浓盐酸的试剂瓶口出现白雾,这是因为浓盐酸挥发出的氯化氢在瓶口处与水蒸气结合成了盐酸小液滴;
(4)硫酸转变为盐酸的化学方程式为:BaCl2+H2SO4═BaSO4↓+2HCl;
(5)为了验证性质⑤,可选用的盐是碳酸钠,因为碳酸钠能和稀盐酸、稀硫酸发生化学反应.
故答案为:(1)红;
(2)Fe2O3+6HCl=2FeCl3+3H2O;
(3)浓盐酸;
(4)BaCl3+H2SO4=BaSO4+2HCl;
(5)HCl和Na2CO3等
点评 酸具有一些相似的化学性质,例如能使石蕊试液变红色,能和某些金属单质、某些金属氧化物、某些盐、碱反应生成相应的物质.

练习册系列答案
相关题目
7.下列日常生活中的现象,遵守质量守恒定律的是( )
| A. | 衣服被淋湿后变重了 | B. | 白醋在敞口容器中放置,质量减少 | ||
| C. | 蜡烛燃烧后质量减少 | D. | 卫生球放在衣柜里质量减少 |
8.按照一定的依据把物质进行分类,是我们认识物质的组成、结构、性质和用途的便捷途径.小明同学在家中建立了小小化学实验室,他收集了许多物质,其中有:①纯碱;②生石灰;③酒精;④熟石灰;⑤尿素CO(NH2)2;⑥铜;⑦石墨;⑧氧化铁.⑨冰醋酸.对上述物质的分类不正确的是( )
| A. | 属于有机物的有③⑤⑨ | B. | 属于碱的有①④ | ||
| C. | 属于氧化物的有②⑧ | D. | 属于单质的有⑥⑦ |
9.下列有关“科学与生活”的说法,不正确的是( )
| A. | 硫酸钡可用于钡餐透视 | B. | 盐类物质都可用于食物调味 | ||
| C. | 熟石灰可用于消毒、杀菌 | D. | 醋可用于除去暖水瓶中的水垢 |
6.在脸盆、菜碟等铁制品的表面烧制搪瓷的主要目的是( )
| A. | 增加厚度,防止撞坏 | B. | 增加厚度,防止磨损 | ||
| C. | 防止生锈且美观 | D. | 美观且有杀菌作用 |
 某澄清溶液由HNO3、Na2SO4、K2CO3、CuCl2 四种物质中的两种组成,向溶液中逐滴加入Ba(OH)2溶液,产生沉淀的质量(m)与加入Ba(OH)2溶液的体积(V)的关系如图所示.则该溶液所含的溶质是HNO3、CuCl2.(填化学式)
某澄清溶液由HNO3、Na2SO4、K2CO3、CuCl2 四种物质中的两种组成,向溶液中逐滴加入Ba(OH)2溶液,产生沉淀的质量(m)与加入Ba(OH)2溶液的体积(V)的关系如图所示.则该溶液所含的溶质是HNO3、CuCl2.(填化学式) 实验室用过氧化氢溶液在二氧化锰作催化剂的条件下制取氧气.小明设计了如右图所示的实验装置,可以通过分液漏斗的活塞控制液体的滴加速度.写出该方法制取氧气反应的化学方程式式2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
实验室用过氧化氢溶液在二氧化锰作催化剂的条件下制取氧气.小明设计了如右图所示的实验装置,可以通过分液漏斗的活塞控制液体的滴加速度.写出该方法制取氧气反应的化学方程式式2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.