题目内容
5.将11克混有氯化钠的碳酸钠放入53.9克稀盐酸中,恰好完全反应.反应后溶液的总质量为60.5克.计算:①原混合物中碳酸钠的质量分数;
②反应后溶液的质量分数.
分析 根据质量守恒定律可计算出二氧化碳的质量,根据化学方程式中二氧化碳和盐酸的质量比可求出碳酸钠和氯化钠的质量,进而计算出原混合物中碳酸钠的质量分数;反应后溶液的质量分数.
解答 解:由质量守恒定律可得二氧化碳的质量:11g+53.9g-60.5g=4.4g
解:(1)设原固体中碳酸钠的质量为X,生成氯化钠的质量为Y.
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 117 44
X Y 4.4g
$\frac{106}{X}$=$\frac{117}{Y}$=$\frac{44}{4.4g}$
X=10.6g Y=11.7g
原混合物中碳酸钠的质量分数$\frac{10.6g}{11g}$×100%=96.4%
(2)反应后的溶液中氯化钠的质量分数为:$\frac{11.7g+(11g-10.6g)}{60.5g}$×100%═20%
答:原混合物中碳酸钠的质量分数96.4%.
反应后的溶液中氯化钠的质量分数为20%.
点评 要想解答好这类题目,要理解和熟记根据化学反应方程式的计算步骤、格式以及与之相关的知识等,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.下列现象中不属于缓慢氧化的是( )
| A. | 动物的呼吸过程 | B. | 电灯发光 | C. | 酒的酿造 | D. | 钢铁生锈 |
15.白色粉末可能含有NaOH、Na2CO3、Na2SO4、NaCl中的一种或几种.为探究白色粉末的组成,将该粉末放入足量水中,充分搅拌后,把所得溶液分为三份进行实验:
(1)第一份溶液中滴加酚酞后,溶液呈红色
(2)第二份溶液中滴加稀盐酸后,开始无明显现象,随着盐酸的滴入逐渐有气泡产生
(3)第三份溶液中滴加足量BaCl2溶液后有白色沉淀生成,过滤,所得沉淀加入足量稀盐酸中全部溶解,滤液中滴加酚酞后,溶液呈无色分析实验得出的以下结论,合理的是( )
(1)第一份溶液中滴加酚酞后,溶液呈红色
(2)第二份溶液中滴加稀盐酸后,开始无明显现象,随着盐酸的滴入逐渐有气泡产生
(3)第三份溶液中滴加足量BaCl2溶液后有白色沉淀生成,过滤,所得沉淀加入足量稀盐酸中全部溶解,滤液中滴加酚酞后,溶液呈无色分析实验得出的以下结论,合理的是( )
| A. | 一定含有Na2CO3,一定没有NaOH Na2SO4,可能含有NaCl | |
| B. | 一定含有NaOH Na2CO3,一定没有Na2SO4,可能含有NaCl | |
| C. | 一定含有Na2CO3,一定没有Na2SO4NaCl,可能含有NaOH | |
| D. | 一定含有Na2CO3 NaCl,一定没有Na2SO4,可能含有NaOH |
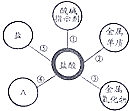 小丽在复习硫酸和盐酸的性质时归纳出,硫酸和盐酸的五条化学性质(如右图所示,连线表示相互反应).
小丽在复习硫酸和盐酸的性质时归纳出,硫酸和盐酸的五条化学性质(如右图所示,连线表示相互反应).