题目内容
17.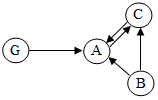 A、B、C是由碳、氢、氧3种元素组成的单质或化合物,其中A、C组成元素相同,G物质是钙的化合物.它们之间的转化关系如图所示.(“→”表示转化关系,部分反应物、生成物及反应条件已略去)
A、B、C是由碳、氢、氧3种元素组成的单质或化合物,其中A、C组成元素相同,G物质是钙的化合物.它们之间的转化关系如图所示.(“→”表示转化关系,部分反应物、生成物及反应条件已略去)①B的化学式可能是C.
②A→C的化学方程式是CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO.
③A→G的化学方程式是CO2+Ca(OH)2=CaCO3↓+H2O.
分析 本题属于推断题,根据题目给出的流程图和信息:其中A、C组成元素相同,碳在氧气中充分燃烧生成二氧化碳,不充分燃烧生成一氧化碳,因此A是二氧化碳,B是碳,C是一氧化碳;G物质是钙的化合物,因此G是碳酸钙;二氧化碳和碳在高温条件下生成一氧化碳,配平即可;二氧化碳和氢氧化钙生成碳酸钙白色沉淀和水.
解答 解:①根据题目给出的流程图和信息:其中A、C组成元素相同,碳在氧气中充分燃烧生成二氧化碳,不充分燃烧生成一氧化碳,因此A是二氧化碳,B是碳,C是一氧化碳;故答案为:C;(合理即可)
②二氧化碳和碳在高温条件下生成一氧化碳,配平即可;故答案为:CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO;
③二氧化碳和氢氧化钙生成碳酸钙白色沉淀和水,故答案为:CO2+Ca(OH)2=CaCO3↓+H2O;
点评 本考点属于物质的推断题,是通过对实验方法和过程的探究,在比较鉴别的基础上,得出了正确的实验结论.本考点是中考的重要内容之一,一般有两种类型:一是图框式推断题;二是文字描述型推断题;本题属于第一种类型.不论哪一种类型,都是通过实验现象,从而得出物质的组成.此考点主要出现在填空题和实验题中.

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
7.纯碱广泛应用于工业生产.现取某纯碱样品(含氯化钠杂质),为确定其中碳酸钠的质量分数,甲、乙两个研究小组分别设计如下实验装置进行探究.
(1)同学们先在实验室把98%的浓硫酸稀释成9.8%的稀硫酸200g,并用其和纯碱样品反应测定碳酸钠的质量分数.
①配制稀硫酸的步骤有:计算、称量、溶解、冷却至室温装瓶并贴上标签,其中用到的下班仪器有量筒、烧杯和玻璃棒.
②需加入水的体积为180mL(水的密度近似看作1g/cm3).
(2)甲组同学采用图1装置,通过测量生成CO2的体积测定碳酸钠的质量分数,(不考虑植物油中溶解CO2产生的影响,碱石灰是氢氧化钠固体与生石灰的混合物).

①若其他操作均正确,仅因下列因素可使碳酸钠的质量分数测定结果偏大的是a(填字母序号);
a.反应后俯视量筒读数b.样品未反应完全即停止验
c.B中未装满液体
②甲组同学测得3组数据如表所示.取3组数据的平均值得到CO2的体积为22.4mL,又知常温常压下CO2的密度为1.964g/L,据此计算碳酸钠的质量分数为53%.
(3)乙组同学采用图2装置,通过测量装置D在反应前后的质量差来测定碳酸钠的质量分数.
①若其他操作均正确,结果仍然偏高的可能原因是碱石灰具有吸水性,若要测定结果列准确需要将装置(如图3所示)接入上述装置的(填编号)A、B之间,装置图3中的液体名称是浓硫酸.
②乙组同学们改进实验装置后(改进装置图略),取21g该纯碱样品加入9.8%的稀硫酸至不再产生气泡,测得反应前后装置D增加了4.4g,求消耗稀硫酸的质量100g(写出计算过程).
(1)同学们先在实验室把98%的浓硫酸稀释成9.8%的稀硫酸200g,并用其和纯碱样品反应测定碳酸钠的质量分数.
①配制稀硫酸的步骤有:计算、称量、溶解、冷却至室温装瓶并贴上标签,其中用到的下班仪器有量筒、烧杯和玻璃棒.
②需加入水的体积为180mL(水的密度近似看作1g/cm3).
(2)甲组同学采用图1装置,通过测量生成CO2的体积测定碳酸钠的质量分数,(不考虑植物油中溶解CO2产生的影响,碱石灰是氢氧化钠固体与生石灰的混合物).

①若其他操作均正确,仅因下列因素可使碳酸钠的质量分数测定结果偏大的是a(填字母序号);
a.反应后俯视量筒读数b.样品未反应完全即停止验
c.B中未装满液体
②甲组同学测得3组数据如表所示.取3组数据的平均值得到CO2的体积为22.4mL,又知常温常压下CO2的密度为1.964g/L,据此计算碳酸钠的质量分数为53%.
| 组别 | 样品质量 | CO2体积 |
| 第1组 | 0.20g | 22.3mL |
| 第2组 | 0.20g | 22.4mL |
| 第3组 | 0.20g | 22.5mL |
①若其他操作均正确,结果仍然偏高的可能原因是碱石灰具有吸水性,若要测定结果列准确需要将装置(如图3所示)接入上述装置的(填编号)A、B之间,装置图3中的液体名称是浓硫酸.
②乙组同学们改进实验装置后(改进装置图略),取21g该纯碱样品加入9.8%的稀硫酸至不再产生气泡,测得反应前后装置D增加了4.4g,求消耗稀硫酸的质量100g(写出计算过程).
6.电影《夏洛特烦恼》中有一句经典语录:有人吧,缺铁:有的人呢,缺钙:而我最缺的是面子,其中的“铁”和“钙”是指( )
| A. | 元素 | B. | 原子 | C. | 单质 | D. | 分子 |

 A、B、C、D、E、F、G为常见的物质,其中B、E、G属于单质,反应②是炼铁工业中的主要反应,它们之间的相互转化关系如图所示:
A、B、C、D、E、F、G为常见的物质,其中B、E、G属于单质,反应②是炼铁工业中的主要反应,它们之间的相互转化关系如图所示:

 水是生命之源,人类的生产、生活都离不开水.
水是生命之源,人类的生产、生活都离不开水.