题目内容
7.纯碱广泛应用于工业生产.现取某纯碱样品(含氯化钠杂质),为确定其中碳酸钠的质量分数,甲、乙两个研究小组分别设计如下实验装置进行探究.(1)同学们先在实验室把98%的浓硫酸稀释成9.8%的稀硫酸200g,并用其和纯碱样品反应测定碳酸钠的质量分数.
①配制稀硫酸的步骤有:计算、称量、溶解、冷却至室温装瓶并贴上标签,其中用到的下班仪器有量筒、烧杯和玻璃棒.
②需加入水的体积为180mL(水的密度近似看作1g/cm3).
(2)甲组同学采用图1装置,通过测量生成CO2的体积测定碳酸钠的质量分数,(不考虑植物油中溶解CO2产生的影响,碱石灰是氢氧化钠固体与生石灰的混合物).

①若其他操作均正确,仅因下列因素可使碳酸钠的质量分数测定结果偏大的是a(填字母序号);
a.反应后俯视量筒读数b.样品未反应完全即停止验
c.B中未装满液体
②甲组同学测得3组数据如表所示.取3组数据的平均值得到CO2的体积为22.4mL,又知常温常压下CO2的密度为1.964g/L,据此计算碳酸钠的质量分数为53%.
| 组别 | 样品质量 | CO2体积 |
| 第1组 | 0.20g | 22.3mL |
| 第2组 | 0.20g | 22.4mL |
| 第3组 | 0.20g | 22.5mL |
①若其他操作均正确,结果仍然偏高的可能原因是碱石灰具有吸水性,若要测定结果列准确需要将装置(如图3所示)接入上述装置的(填编号)A、B之间,装置图3中的液体名称是浓硫酸.
②乙组同学们改进实验装置后(改进装置图略),取21g该纯碱样品加入9.8%的稀硫酸至不再产生气泡,测得反应前后装置D增加了4.4g,求消耗稀硫酸的质量100g(写出计算过程).
分析 (1)①根据配制一定质量分数溶液步骤是:计算、称量、溶解、装瓶,用到的玻璃仪器有量筒、烧杯和玻璃棒进行分析;
②根据溶剂质量等于溶液质量-溶质的质量进行分析;
(2)①根据二氧化碳的体积偏大,会导致碳酸钠的质量分数偏大;样品未反应完全,即停止,会使收集的二氧化碳体积偏小进行分析;
②根据多次测量求平均值,可以减小实验误差,依据碳酸钠和硫酸反应的化学方程式进行计算;
(3)①根据碱石灰具有吸水性,浓硫酸具有吸水性进行分析;
②根据碱石灰增加的质量就是二氧化碳的质量,依据化学方程式进行计算.
解答 解:(1)配制一定质量分数溶液步骤是:计算、称量、溶解、装瓶,用到的玻璃仪器有量筒、烧杯和玻璃棒;
②溶剂质量等于溶液质量-溶质的质量,所以需加入水的质量为:200g-$\frac{200g×9.8%}{98%}$=180g,合180mL;
(2)①二氧化碳的体积偏大,会导致碳酸钠的质量分数偏大;
a.反应后俯视量筒读数,会使二氧化碳的体积偏大,会导致碳酸钠的质量分数偏大,故正确;
b.样品未反应完全,即停止,会使收集的二氧化碳体积偏小,故错误;
c.B中未装满液体,不会影响二氧化碳排除水的体积,故错误;
故选:a;
②多次测量求平均值,可以减小实验误差,所以取3组数据的平均值得到CO2的体积为:$\frac{22.3mL+22.4mL+22.5mL}{3}$=22.4mL,二氧化碳的质量为:22.4mL×÷1000=0.44g,
设碳酸钠的质量分数为x
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106 44
x×2g 0.44g
$\frac{106}{x×2g}$=$\frac{44}{0.44g}$
x=53%
(3)①碱石灰具有吸水性,浓硫酸具有吸水性,所以其他操作均正确,结果仍然偏高的可能原因是:碱石灰具有吸水性,若要测定结果列准确需要将装置(如图3所示)接入上述装置的(填编号)A、B之间,装置图3中的液体名称是浓硫酸;
②碱石灰增加的质量就是二氧化碳的质量,
设参加反应的稀硫酸的质量为x
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
98 44
x×9.8% 4.4g
$\frac{98}{x×9.8%}$=$\frac{44}{4.4g}$
x=100g
故答案为:(1)称量、溶解,玻璃棒;
②180mL;
(2)①a;
②22.4mL,x=53%;
(3)①碱石灰具有吸水性,A、B,浓硫酸;
②100g.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

| A. | 苹果汁:3.1 | B. | 玉米粥:7.5 | C. | 牛奶:6.5 | D. | 番茄汁:4.2 |
| A. | 1:9 | B. | 2:9 | C. | 16:9 | D. | 23:9 |
| A. | 矿石粉碎 | B. | 冰雪融化 | C. | 车轮胎爆炸 | D. | 铁生锈 |
 ”表示有可循环利用的物质)
”表示有可循环利用的物质)

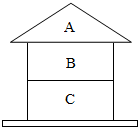 同学们以盖房子的方式总结出如图物质间的关系,A,B,C均为纯净物.且上、下相邻物质间均可发生反应,回答下列问题:
同学们以盖房子的方式总结出如图物质间的关系,A,B,C均为纯净物.且上、下相邻物质间均可发生反应,回答下列问题: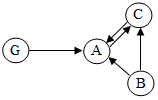 A、B、C是由碳、氢、氧3种元素组成的单质或化合物,其中A、C组成元素相同,G物质是钙的化合物.它们之间的转化关系如图所示.(“→”表示转化关系,部分反应物、生成物及反应条件已略去)
A、B、C是由碳、氢、氧3种元素组成的单质或化合物,其中A、C组成元素相同,G物质是钙的化合物.它们之间的转化关系如图所示.(“→”表示转化关系,部分反应物、生成物及反应条件已略去)