题目内容
6.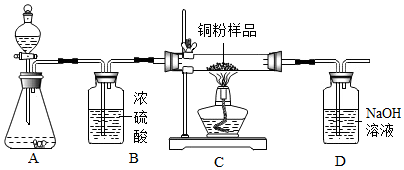 某化学兴趣小组用过氧化氢溶液(MnO2作催化剂)制取干燥的氧气,并用来测定10g某铜粉样品(含杂质碳)中铜的质量分数,实验装置如图所示.
某化学兴趣小组用过氧化氢溶液(MnO2作催化剂)制取干燥的氧气,并用来测定10g某铜粉样品(含杂质碳)中铜的质量分数,实验装置如图所示.(1)装置B中浓硫酸的作用是吸收水蒸气.
(2)装置D中发生反应的化学方程式为2NaOH+CO2═Na2CO3+H2O.小刚同学认为通过称量反应前后装置D的质量,进行计算便可求出样品中铜的质量分数.小婷同学认为小刚的方法有缺陷,原因是空气中含有的二氧化碳会进入D中被氢氧化钠溶液吸收,通过讨论,认为如果要用小刚同学的方法准确求出铜的质量分数,则应该在装置D之后连接一个装有碱石灰的干燥管消除影响.
(3)实验完毕,小聪同学误将用剩的H2O2溶液和装置C中的剩余固体仪器倒入烧杯中,发现有大量的气泡产生,经检验确认产生的气体是氧气.小明和小红两位同学对此颇感兴趣,进而展开了他们的探究之旅.
【提出问题】是粉末中的哪种物质加快了H2O2的分解速率?
【大胆猜想】猜想Ⅰ:剩余固体中的氧化剂加快了H2O2的分解速率;
猜想Ⅱ:剩余固体中的铜粉加快了H2O2的分解速率;
【实验设计】
| 实验操作 | 实验现象 | 分析及结论 |
| 实验一:将带火星的木条伸入盛有5mL5%H2O2溶液的试管 | 带火星的木条不能复燃 | H2O2溶液常温下产生氧气的量很少,不足以使带火星的木条复燃 |
| 实验二:向盛有5mL5%H2O2溶液的试管中加入1g氧化铜固体,将一根带火星的木条伸入试管 | 产生大量气泡,带火星的木条复燃 | 氧化铜能够加快过氧化氢的分解速率 |
| 实验三: 向盛有5mL5%H2O2溶液的试管中加入1g铜粉,将一根带火星的木条伸入试管 | 带火星的木条不能复燃 | 猜想Ⅱ不成立 |
分析 (1)浓硫酸具有吸水性,可以用作氢气、氧气、二氧化碳等气体的干燥剂;
(2)氢氧化钠能够吸收二氧化碳,能和二氧化碳反应生成碳酸钠和水;
碱石灰能够吸收二氧化碳和水蒸气;
(3)过氧化氢分解生成水和氧气,氧气能使带火星的木条复燃;
催化剂能够改变化学反应的速率,而本身的质量和化学性质在反应前后不变.
解答 解:(1)装置B中浓硫酸的作用是吸收水蒸气.
故填:吸收水蒸气.
(2)装置D中,氢氧化钠和二氧化碳反应生成碳酸钠和水,发生反应的化学方程式为:2NaOH+CO2═Na2CO3+H2O;
小婷同学认为小刚的方法有缺陷,原因是空气中含有的二氧化碳会进入D中被氢氧化钠溶液吸收;
如果要用小刚同学的方法准确求出铜的质量分数,则应该在装置D之后连接一个装有碱石灰的干燥管消除影响.
故填:2NaOH+CO2═Na2CO3+H2O;空气中含有的二氧化碳会进入D中被氢氧化钠溶液吸收;D.
(3)【实验设计】
实验过程如下表所示:
| 实验操作 | 实验现象 | 分析及结论 |
| 实验一:将带火星的木条伸入盛有5mL5%H2O2溶液的试管 | 带火星的木条不能复燃 | H2O2溶液常温下产生氧气的量很少,不足以使带火星的木条复燃 |
| 实验二:向盛有5mL5%H2O2溶液的试管中加入1g氧化铜固体,将一根带火星的木条伸入试管 | 产生大量气泡,带火星的木条复燃 | 氧化铜能够加快过氧化氢的分解速率 |
| 实验三:向盛有5mL5%H2O2溶液的试管中加入1g铜粉,将一根带火星的木条伸入试管 | 带火星的木条不能复燃 | 猜想Ⅱ不成立 |
故填:不能确定反应前后氧化铜的质量和化学性质是否改变.
点评 实验现象是物质之间相互作用的外在表现,因此要学会设计实验、观察实验、分析实验,为揭示物质之间相互作用的实质奠定基础.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
14.下列物质中,不溶于水,但能跟硫酸溶液反应的是( )
| A. | Cu | B. | CO2 | C. | CuO | D. | CaO |
 某元素A的原子结构示意图如图
某元素A的原子结构示意图如图 
 探究酸和碱化学性质的实验中使用的白色点滴板,实验时使用它的优点有哪些?(答二点即可)
探究酸和碱化学性质的实验中使用的白色点滴板,实验时使用它的优点有哪些?(答二点即可)