题目内容
17.如图为“一氧化碳与氧化铁反应”的实验装置.该反应利用CO的还原性,将Fe2O3中的铁还原出来.
(1)写出高温条件下CO与Fe2O3反应的化学方程式3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(2)实验过程中,常在装置图末端的导管口放一盏燃着的酒精灯(灯焰处于导管口),这样做的目的是防止反应剩余的一氧化碳逸散,污染空气.
(3)通过B装置可检验A中的生成物含有CO2,该反应的化学方程式为Ca(OH)2+CO2═CaCO3↓+H2O.
(4)在此实验中,我们还认识到CO和CO2的化学性质有许多的不同.
①请写出其中的一点一氧化碳可燃,二氧化碳不可燃.
②试从微观的角度分析CO和CO2化学性质不同的原因是CO与CO2分子的结构不同.
分析 (1)由题意可知:反应物为一氧化碳与氧化铁,反应条件为高温,生成物为铁与二氧化碳;
(2)根据一氧化碳的毒性分析;
(3)根据反应的原理来书写化学方程式;
(4)根据二者性质的差异以及一氧化碳和二氧化碳的分子结构不同,决定了二者的性质不同来分析.
解答 解:(1)由题意可知反应物、反应条件、生成物,故写出CO与Fe2O3在高温条件下反应的化学方程式:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$ 2Fe+3CO2;故填:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$ 2Fe+3CO2;
(2)一氧化碳有毒,不能直接排放到空气中,因此要在装置图末端的导气管口放一盏燃着的酒精灯将一氧化碳燃烧除去,防止污染空气;
故填:防止反应剩余的一氧化碳逸散,污染空气;
(3)二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水,故填:Ca(OH)2+CO2═CaCO3↓+H2O;
(4)①由该实验可知一氧化碳可燃,二氧化碳不可燃,二氧化碳能使澄清的石灰水变浑浊,一氧化碳不能;故填:一氧化碳可燃,二氧化碳不可燃(答案合理即可);
②一氧化碳和二氧化碳的分子结构不同,决定了二者的性质不同;故填:CO与CO2分子的结构不同.
点评 本题考查一氧化碳还原氧化铁的原理、实验现象及操作注意事项,要根据已有的知识进行分析解答.

练习册系列答案
相关题目
9.下列关于氧气的说法中正确的是( )
| A. | 氧气在低温、高压的条件下可以转变为无色液体或固体 | |
| B. | 氧气的重要来源是植物光合作用 | |
| C. | 氧气的化学性质比较活泼,是可燃物 | |
| D. | 因为氧气与氮气的密度不同,所以工业上用分离液态空气法制取氧气 |
6.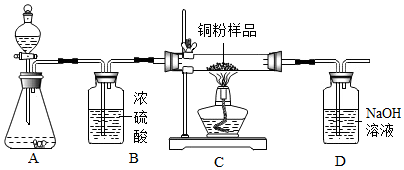 某化学兴趣小组用过氧化氢溶液(MnO2作催化剂)制取干燥的氧气,并用来测定10g某铜粉样品(含杂质碳)中铜的质量分数,实验装置如图所示.
某化学兴趣小组用过氧化氢溶液(MnO2作催化剂)制取干燥的氧气,并用来测定10g某铜粉样品(含杂质碳)中铜的质量分数,实验装置如图所示.
(1)装置B中浓硫酸的作用是吸收水蒸气.
(2)装置D中发生反应的化学方程式为2NaOH+CO2═Na2CO3+H2O.小刚同学认为通过称量反应前后装置D的质量,进行计算便可求出样品中铜的质量分数.小婷同学认为小刚的方法有缺陷,原因是空气中含有的二氧化碳会进入D中被氢氧化钠溶液吸收,通过讨论,认为如果要用小刚同学的方法准确求出铜的质量分数,则应该在装置D之后连接一个装有碱石灰的干燥管消除影响.
(3)实验完毕,小聪同学误将用剩的H2O2溶液和装置C中的剩余固体仪器倒入烧杯中,发现有大量的气泡产生,经检验确认产生的气体是氧气.小明和小红两位同学对此颇感兴趣,进而展开了他们的探究之旅.
【提出问题】是粉末中的哪种物质加快了H2O2的分解速率?
【大胆猜想】猜想Ⅰ:剩余固体中的氧化剂加快了H2O2的分解速率;
猜想Ⅱ:剩余固体中的铜粉加快了H2O2的分解速率;
【实验设计】
【烦死拓展】同学们讨论后认为,上述实验还不能够确切地说明氧化铜就是过氧化氢分解制取氧气的催化剂,理由是不能确定反应前后氧化铜的质量和化学性质是否改变.
 某化学兴趣小组用过氧化氢溶液(MnO2作催化剂)制取干燥的氧气,并用来测定10g某铜粉样品(含杂质碳)中铜的质量分数,实验装置如图所示.
某化学兴趣小组用过氧化氢溶液(MnO2作催化剂)制取干燥的氧气,并用来测定10g某铜粉样品(含杂质碳)中铜的质量分数,实验装置如图所示.(1)装置B中浓硫酸的作用是吸收水蒸气.
(2)装置D中发生反应的化学方程式为2NaOH+CO2═Na2CO3+H2O.小刚同学认为通过称量反应前后装置D的质量,进行计算便可求出样品中铜的质量分数.小婷同学认为小刚的方法有缺陷,原因是空气中含有的二氧化碳会进入D中被氢氧化钠溶液吸收,通过讨论,认为如果要用小刚同学的方法准确求出铜的质量分数,则应该在装置D之后连接一个装有碱石灰的干燥管消除影响.
(3)实验完毕,小聪同学误将用剩的H2O2溶液和装置C中的剩余固体仪器倒入烧杯中,发现有大量的气泡产生,经检验确认产生的气体是氧气.小明和小红两位同学对此颇感兴趣,进而展开了他们的探究之旅.
【提出问题】是粉末中的哪种物质加快了H2O2的分解速率?
【大胆猜想】猜想Ⅰ:剩余固体中的氧化剂加快了H2O2的分解速率;
猜想Ⅱ:剩余固体中的铜粉加快了H2O2的分解速率;
【实验设计】
| 实验操作 | 实验现象 | 分析及结论 |
| 实验一:将带火星的木条伸入盛有5mL5%H2O2溶液的试管 | 带火星的木条不能复燃 | H2O2溶液常温下产生氧气的量很少,不足以使带火星的木条复燃 |
| 实验二:向盛有5mL5%H2O2溶液的试管中加入1g氧化铜固体,将一根带火星的木条伸入试管 | 产生大量气泡,带火星的木条复燃 | 氧化铜能够加快过氧化氢的分解速率 |
| 实验三: 向盛有5mL5%H2O2溶液的试管中加入1g铜粉,将一根带火星的木条伸入试管 | 带火星的木条不能复燃 | 猜想Ⅱ不成立 |