题目内容
11.(1)小丽在购买的袋装薯片中发现有一个小袋,上面标有“成分:CaO、Fe;作用:防潮、防氧化;警告:禁止食用”等字样,撕开小袋,发现里面的固体粉末有少许是棕红色的,大多数是灰白色的.经过分析,她认为棕红色粉末是Fe2O3,灰白色粉末应该含有CaCO3和Fe,为验证自己的判断,小丽打算进行实验探究,请你一同参与.【实验目的】证实灰白色粉末中含有CaCO3和Fe.
【查阅资料】①氢气具有还原性,能夺取某些金属氧化物中的氧,使金属还原,
②白色的无水硫酸铜遇水变成蓝色.
【实验设计】装置如图所示:

【实验预测与分析】
①若要证实样品中含有CaCO3,B中观察到的实验现象是澄清的石灰水变浑浊,B中发生反应的化学方程式为CO2+Ca(OH)2=CaCO3↓+H2O.
②若要证实样品中含有Fe,D中应观察到的实验现象是黑色固体变成红色,E中应观察到的实验现象是白色固体变成蓝色.
③看了小丽的分析结论,有同学认为小袋内灰白色粉末中还应该有别的物质,请你写出其中一种物质的化学式CaO或Ca(OH)2.
④小丽认为棕红色粉末Fe2O3也能与盐酸反应,请你写出反应的化学方程式Fe2O3+6HCl=2FeCl3+3H2O.
(2)黄铜是铜、锌合金,它可用来制造机器、电器零件及日用品.为测定某黄铜中铜的质量分数,现取20g该样品粉碎,加入到100g稀硫酸中,恰好完全反应,反应后测得烧杯中剩余物的总质量为119.6克.
①反应生成氢气的质量是0.4g,
②黄铜样品中铜的质量分数是35%,
③计算稀硫酸中溶质的质量分数.(写出计算过程)
分析 (1)①若样品中含有CaCO3,它会与盐酸反应,生成气体;产生的气体能与澄清石灰水反应;
②若样品中含有Fe,它与盐酸反应生成能还原氧化铜的氢气,还原氧化铜时有水生成;
③样品中成分可能未完全变质,可能含有氧化钙,并依据氧化钙和水反应生成氢氧化钙的性质解答;
④根据氧化铁与稀盐酸反应生成氯化铁和水解答;
(2)①根据铜和锌的性质可知,加入稀硫酸时,只有锌与硫酸反应生成了硫酸锌和氢气,根据质量守恒定律可知,减少的质量就是生成氢气的质量;
②根据锌与硫酸反应的方程式,由氢气的质量可以求出锌的质量,进而求出铜的质量和铜的质量分数;
③根据方程式和“溶质质量分数=$\frac{溶质质量}{溶液质量}$×100%”计算即可.
解答 解:(1)①若样品中含有CaCO3,CaCO3能与盐酸反应生成二氧化碳气体,观察到的实验现象是生成的气体二氧化碳进入B,与其中的其中的澄清石灰水反应生成沉淀,反应方程式是CO2+Ca(OH)2=CaCO3↓+H2O;
故答案为:澄清的石灰水变浑浊;CO2+Ca(OH)2=CaCO3↓+H2O;
②若样品中含有Fe,Fe与盐酸反应生成氢气,氢气到达D装置后还原氧化铜,生成铜和水,反应中黑色粉末变为红色;水蒸气进入E装置,可以看到E中的无水硫酸铜变蓝;
故答案为:黑色固体变成红色; 白色固体变成蓝色;
③因为小袋上面标有成分:CaO、Fe,其中的CaO可能有部分未变质;可能会吸收空气中的水分,生成Ca(OH)2,二者都是灰白色固体,所以灰白色粉末中还应该有CaO或Ca(OH)2.
故答案为:CaO或Ca(OH)2;
④氧化铁与稀盐酸反应生成氯化铁和水.该反应的化学方程式为:Fe2O3+6HCl=2FeCl3+3H2O;
(2)①根据质量守恒定律可知,生成的氢气的质量为:100g+20g-119.6g=0.4g
故答案为:0.4g;
②设样品中锌的质量是X,设稀硫酸中溶质的质量为Y
Zn+H2SO4=ZnSO4+H2↑
65 98 2
X Y 0.4g
$\frac{65}{X}=\frac{98}{Y}=\frac{2}{0.4g}$
解得:X=13g Y=19.6g
所以样品中铜的质量为:20g-13g=7g
样品中铜的质量分数是$\frac{7g}{20g}$×100%=35%
故答案为:35%;
③稀硫酸中的溶质的质量分数=$\frac{19.6g}{100g}$×100%=19.6%
答:稀硫酸中溶质的质量分数为19.6%.
点评 本题考查了物质的化学性质及反应时的现象和根据化学方程式的计算,因此熟练掌握物质的化学性质、方程式计算,再结合题中情境不难解答.

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案| A. |  | B. |  | C. |  | D. |  |
| A. | 水的净化 | B. | 太阳能分解水制氢气 | ||
| C. | 海水晒盐 | D. | 肥皂水区分硬水和软水 |
| A. | 化工企业需要大量的水 | |
| B. | 便于向长江内大量排污水 | |
| C. | 便于原材料和产品的运输 | |
| D. | 减少化工企业生产过程中三废对人口稠密地区的危害 |

【提出问题1】固体A除了杂质外的成分是什么?
【猜想与假设】甲同学:只有CaCO3 乙同学:CaCO3、Ca(OH)2
【实验与探究】甲、乙同学为了验证各自的猜想,分别进行了实验:
| 实验内容 | 实验现象 | 实验结论 |
| 甲同学:取少量固体于试管中,向其中加入稀盐酸 | 有气泡产生 | 自己的猜想正确 |
| 乙同学:取少量固体于试管中,加水充分溶解、过滤,向滤液中滴加酚酞试液,向滤渣中滴加稀盐酸 | 溶液由无色变为红色,滤渣表面有气泡产生 | 自己的猜想正确 |
【提出问题2】溶液B中的溶质除KOH外,还含有的物质是什么?
【猜想与假设】丙同学:K2CO3 丁同学:Ca(OH)2
【表达与交流】结合对固体成分的探究,同学们经过讨论确定了丁同学猜想正确,理由是固体中含有氢氧化钙,说明溶液中的碳酸钾已完全反应.为了得到纯净的氢氧化钾,需要向溶液B中滴加适量的一种溶液,发生反应的化学方程式为K2CO3+Ca(OH)2═CaCO3↓+2KOH,小组同学通过相应的实验操作最终制得了氢氧化钾.
 如图所示,电源电压恒定,甲、乙两杯中分别倒入相同质量分数的稀H2SO4,合上开关后,发现 V1、V2表读数U1、U2相同,小灯泡正常发光,下面说法正确的是( )
如图所示,电源电压恒定,甲、乙两杯中分别倒入相同质量分数的稀H2SO4,合上开关后,发现 V1、V2表读数U1、U2相同,小灯泡正常发光,下面说法正确的是( )| A. | 若将甲溶液中的两极靠近,会发现U2变小 | |
| B. | 若往乙溶液中滴入少量Ba(OH)2溶液,会发现U2变小 | |
| C. | 若往甲溶液中逐渐滴入Ba(OH)2溶液直到过量,小灯泡先变暗后变亮 | |
| D. | 溶液导电的原因是通电后稀H2SO4发生电离的缘故 |

【提出问题】久置固体的成分是什么?
【查阅资料】铁与氯化铁溶液在常温下发生反应生成氯化亚铁.
【作出猜想】久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3.
【实验探究】南南同学的方案:(2分)
| 实验操作 | 实验现象 | 实验结论 |
| 取少量固体放于试管中,滴加足量的稀盐酸. | 固体逐渐消失,有无色气体产生,得到浅绿色溶液. | 固体中一定含有Fe,一定不含Fe2O3. |
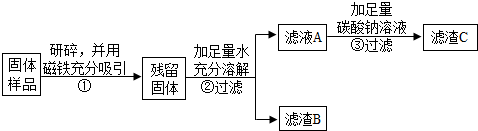
(1)步骤①样品用磁铁吸引前需经过研碎,其中研碎的目的是增大接触面积,使反应充分.
(2)步骤②中固体溶解时放出大量热,由此可以判断固体一定含有CaO.写出该过程中的化学方程式CaO+H2O=Ca(OH)2.
(3)步骤③中反应的化学方程式是Na2CO3+Ca(OH)2=CaCO3↓+2NaOH.
北北同学对滤渣B又进行探究.
| 实验操作 | 实验现象 | 实验结论 |
| ①取滤渣B于试管中,加入适量稀盐酸 ②生成的气体通入澄清石灰水 | ①有气泡冒出 溶液变为黄色②该溶液变浑浊. | 固体中一定含有CaCO3和Fe2O3. |
 在学校的元旦联欢会上,某同学表演了“水能生火”的魔术.他向包有过氧化钠(Na2O2)粉末的脱脂棉上滴水,脱脂棉燃烧起来.
在学校的元旦联欢会上,某同学表演了“水能生火”的魔术.他向包有过氧化钠(Na2O2)粉末的脱脂棉上滴水,脱脂棉燃烧起来.