题目内容
3.打雷放电时,空气中有极少的氧气会转化为臭氧,试想想该变化属于化学变化;氧气和臭氧(填“是”或“不是”)不是同种物质.
分析 本题考查学生对物理变化和化学变化的确定.判断一个变化是物理变化还是化学变化,要依据在变化过程中有没有生成其他物质,生成其他物质的是化学变化,没有生成其他物质的是物理变化.
解答 解:氧气是由氧分子构成,臭氧是由臭氧分子构成,属于两种不同的物质,由一种物质变为另一种物质,属于化学变化;氧气和臭氧不是同种物质.
故答案为:化学;不是.
点评 要熟记物理变化与化学变化的本质区别:是否有新物质生成,有新物质生成属于化学变化,没有新物质生成属于物理变化.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.如图是X、Y、Z、W四种溶液的近似pH,下列判断中不正确的是( )
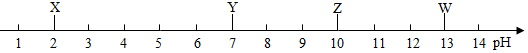

| A. | X一定显酸性 | B. | Y一定是水 | ||
| C. | Z不一定是碱溶液 | D. | W的碱性一定比Z强 |
14.(1)为证明中和反应是放热反应,某小组进行了如图所示的实验操作: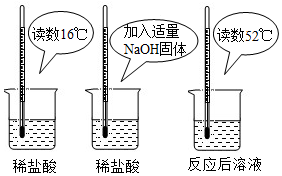
根据如图实验,甲同学认为:NaOH与稀盐酸发生的中和反应是放热反应.乙同学认为:甲同学得出这个结论的依据不科学,理由是氢氧化钠固体溶于水放热.丙同学认为:通过多个实验才能得出一个普遍的结论.请你再举出一个酸碱中和反应的实例,写出反应的化学方程式2NaOH+H2SO4═Na2SO4+2H2O.
(2)为探究影响中和反应放出热量多少的因素,他们又进行了如下实验:在编号为A、B、C、D、E的五只烧杯中各装入36.5g 溶质质量分数为5%、10%、15%、20%、25%的盐酸,再向上述五只烧杯中分别加入40g20% 的氢氧化钠溶液,最后测量其温度,数据记录如下:
【实验结论】影响中和反应放出热量多少的因素是反应物的浓度.
【交流反思】反应后,烧杯内溶液pH最小的是E(填烧杯编号).
(3)若要使40g20%的氢氧化钠溶液恰好完全中和,则需要10%的盐酸溶液多少克?(根据化学方程式列式计算)

根据如图实验,甲同学认为:NaOH与稀盐酸发生的中和反应是放热反应.乙同学认为:甲同学得出这个结论的依据不科学,理由是氢氧化钠固体溶于水放热.丙同学认为:通过多个实验才能得出一个普遍的结论.请你再举出一个酸碱中和反应的实例,写出反应的化学方程式2NaOH+H2SO4═Na2SO4+2H2O.
(2)为探究影响中和反应放出热量多少的因素,他们又进行了如下实验:在编号为A、B、C、D、E的五只烧杯中各装入36.5g 溶质质量分数为5%、10%、15%、20%、25%的盐酸,再向上述五只烧杯中分别加入40g20% 的氢氧化钠溶液,最后测量其温度,数据记录如下:
| 烧杯编号 | A | B | C | D | E |
| 盐酸的溶质质量分数 | 5% | 10% | 15% | 20% | 25% |
| 反应后溶液温度(℃) | 24℃ | 34℃ | 46℃ | 54℃ | 54℃ |
【交流反思】反应后,烧杯内溶液pH最小的是E(填烧杯编号).
(3)若要使40g20%的氢氧化钠溶液恰好完全中和,则需要10%的盐酸溶液多少克?(根据化学方程式列式计算)
18.人类生活离不开空气.下列说法不正确的是( )
| A. | 空气的成分以氮气和氧气为主 | |
| B. | 空气中0.94%的稀有气体属于纯净物 | |
| C. | 氧气能供给呼吸,可用于医疗急救 | |
| D. | 氮气的化学性质不活泼,可用作保护气 |
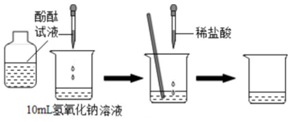
8.往盐酸溶液里加入一定量的氢氧化钠溶液,无任何明显现象.以下实验操作一定可证明二者确实发生了反应的是( )
| A. | 测量混合前后溶液的pH值,发现混合后溶液的pH值升高了 | |
| B. | 往反应后溶液中加入酚酞,发现酚酞变红 | |
| C. | 往反应后溶液中滴加硝酸银溶液,出现了白色沉淀 | |
| D. | 往反应后溶液中加入金属锌,无任何现象 |
12.下列与生活相关的说法中错误的是( )
| A. | 工业用盐亚硝酸钠可以代替食盐用于烹任 | |
| B. | 碳酸钙可以用作补钙剂 | |
| C. | 碳酸氢钠是发酵粉的主要成分之一 | |
| D. | 氯化钠可用于消除公路积雪 |
 实验室进行科学探究是化学学习的重要方式.请填写下列空格:
实验室进行科学探究是化学学习的重要方式.请填写下列空格: