题目内容
1. 水和溶液在生命活动和生产、生活中起着十分重要的作用.
水和溶液在生命活动和生产、生活中起着十分重要的作用.(1)“生命吸管”(如图)是一种可以随身携带的小型水净化器,里面装有网丝、注入了活性炭和碘的树脂等.其中活性炭起到吸附和过滤作用.
(2)水常用来配制各种溶液,硫酸铜溶液中的溶质为CuSO4.(填化学式)
(3)农业生产常用溶质的质量分数为10%~20%的NaCl溶液来选种.这是利用物质的物理性质.(填“物理”或“化学”)
(4)根据表回答问题.
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度/g | NaCl | 35.7 | 36.0 | 36.5 | 37.3 | 38.4 | 39.8 |
| NH4Cl | 29.4 | 37.2 | 45.8 | 55.2 | 65.6 | 77.3 | |
②采用一种操作方法,将上述烧杯中的剩余固体全部溶解,变为不饱和溶液.下列说法正确的是D(填字母序号)
A.溶质的质量不变 B.溶液中溶质的质量分数一定减小
C.溶液质量可能不变 D.可升高温度或增加溶剂.
分析 (1)根据活性炭具有吸附作用,能吸附色素和异味,进行分析判断.
(2)硫酸铜溶液是硫酸铜的水溶液,进行分析解答.
(3)农业生产常用溶质的质量分数为10%~20%的NaCl溶液来选种,是利用的10%~20%的NaCl溶液的密度比瘪的种子的密度大的性质,进行分析解答.
(4)①根据60℃时,NaCl和NH4Cl的溶解度分别为37.3g、55.2g,进行分析解答.
②采用一种操作方法,将上述烧杯中的剩余固体全部溶解,变为不饱和溶液,可以采用升高温度或加水的方法,进行分析解答.
解答 解:(1)活性炭具有吸附性,能吸附色素和异味,故“生命吸管”中的活性炭起吸附作用.
(2)硫酸铜溶液是硫酸铜的水溶液,溶质为硫酸铜,其化学式为:CuSO4.
(3)农业生产常用溶质的质量分数为10%~20%的NaCl溶液来选种,是利用的10%~20%的NaCl溶液的密度比瘪的种子的密度大的性质,这是利用物质的物理性质.
(4)①60℃时,NaCl和NH4Cl的溶解度分别为37.3g、55.2g,即该温度下,100g水中最多溶解NaCl37.3g、55.2g氯化铵,则60℃时,向两个分别盛有38g NaCl和NH4Cl的烧杯中,各加入100g水,充分溶解后,氯化钠有剩余,则氯化钠溶液为饱和溶液.
②采用一种操作方法,将上述烧杯中的剩余固体全部溶解,变为不饱和溶液,可以采用升高温度或加水的方法,剩余固体全部溶解,溶质的质量增加,溶液中溶质的质量分数增大,溶液质量增加.
故答案为:(1)吸附;(2)CuSO4;(3)物理;(4)①NaCl;②D.
点评 本题难度不是很大,掌握饱和溶液与不饱和溶液的特征与转化方法、活性炭具有吸附性、溶质与溶剂的判别方法等是正确解答本题的关键.

练习册系列答案
相关题目
11.氮气的用途也很广泛,下列属于氮气用途的是( )
| A. | 合成氨制作氮肥 | B. | 充入灯泡作保护气 | ||
| C. | 作为火箭发射的推进剂 | D. | 医疗上可作为危重病人的急救气 |
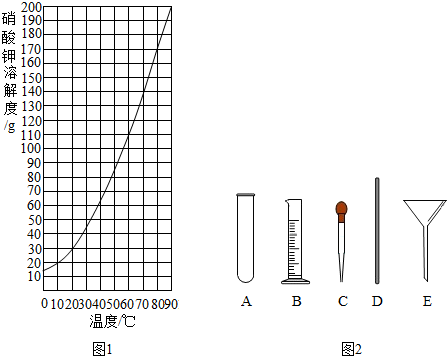
6.实验室需配制一定浓度的硝酸钾溶液.
(1)查阅硝酸钾溶解性.由图可知,20℃时,硝酸钾的溶解度为31.6g,在该温度下配制硝酸钾溶液,溶质质量分数最大为24%(计算结果保留整数).
(2)计算.配制40g质量分数为10%的硝酸钾溶液,所需硝酸钾的质量为4g,所需蒸馏水的体积为36mL
(3)称量.分别在天平左右两盘放上纸片,调节平衡后,A(填字母).
A.先移动游码到所需位置,再添加硝酸钾直到天平平衡
B.先添加所需的硝酸钾,再移动游码直到天平平衡
(4)量取.量取所需蒸馏水要用到的仪器是图2中的BC(填字母).
(5)溶解.将称量好的硝酸钾和蒸馏水混合溶解.
(6)稀释.20℃时,将20mL质量分数为10%的硝酸钾溶液,稀释成质量分数为4%的硝酸钾溶液.从表中找出需要用到的数据:g/mL.
硝酸钾溶液的密度(单位g/mL)
(1)查阅硝酸钾溶解性.由图可知,20℃时,硝酸钾的溶解度为31.6g,在该温度下配制硝酸钾溶液,溶质质量分数最大为24%(计算结果保留整数).
(2)计算.配制40g质量分数为10%的硝酸钾溶液,所需硝酸钾的质量为4g,所需蒸馏水的体积为36mL
(3)称量.分别在天平左右两盘放上纸片,调节平衡后,A(填字母).
A.先移动游码到所需位置,再添加硝酸钾直到天平平衡
B.先添加所需的硝酸钾,再移动游码直到天平平衡
(4)量取.量取所需蒸馏水要用到的仪器是图2中的BC(填字母).

(5)溶解.将称量好的硝酸钾和蒸馏水混合溶解.
(6)稀释.20℃时,将20mL质量分数为10%的硝酸钾溶液,稀释成质量分数为4%的硝酸钾溶液.从表中找出需要用到的数据:g/mL.
硝酸钾溶液的密度(单位g/mL)
| 温度/℃ 质量分数/% | 20 | 40 | 60 |
| 4 | 1.023 | 1.016 | 1.007 |
| 10 | 1.063 | 1.054 | 1.044 |
13.某化学兴趣小组取用2.0g石灰石样品,把25.0g质量分数为10%的稀盐酸分五次加入样品中(样品中的杂质既不与盐酸反应,也不溶解于水),每次充分反应后都经过滤、干燥、称量,得实验数据如表:
请计算:
(1)2.0g石灰石样品中碳酸钙的质量为1.7g,石灰石中碳酸钙的质量分数为85%.
(2)请你继续计算反应生成溶液中溶质的质量分数(计算过程和结果均保留一位小数).
| 实验次数 | 1 | 2 | 3 | 4 | 5 |
| 稀盐酸的累计加入量 | 5.0g | 10.0g | 15.0g | 20.0g | 25.0g |
| 剩余固体的质量 | 1.5g | 1.0g | 0.5g | 0.3g | 0.3g |
(1)2.0g石灰石样品中碳酸钙的质量为1.7g,石灰石中碳酸钙的质量分数为85%.
(2)请你继续计算反应生成溶液中溶质的质量分数(计算过程和结果均保留一位小数).

