题目内容
19.阅读短文,回答问题.雾霾
雾霾,雾和霾的统称.雾是由近地面层空气中水蒸气凝结的产物.霾,是指空气中的灰尘、硫酸、硝酸、有机碳氧化合物等颗粒物使大气混浊的现象.
颗粒物的英文缩写为PM,天气预报中的PM2.5是指大气中直径小于或等于2.5μm的颗粒物,也称为可入肺颗粒物.这种颗粒物本身既是一种污染物,又是重金属、多环芳烃等有毒物质的载体.
2012-2013年石家庄冬季雾霾天气尤其多,主要原因是:
-----在水平方向静风现象增多.城市里大楼越建越高,阻挡和摩擦作用使风流经城区时明显减弱,不利于大气中悬浮微粒的扩散稀释;
-----垂直方向出现逆温.高空的气温比低空气温更高的逆温现象,不易形成风,使空气中悬浮微粒难以向高空飘散而阻滞在低空和近地面;
-----空气中悬浮颗粒物的增加.城市人口的增长和工业发展、机动车辆猛增,污染物排放和悬浮物大量增加.
(1)“雾”的形成是液化(选填物态变化名称);
(2)雾粒直径大约是0.03mm~0.06mm左右,监测的PM2.5颗粒物直径小于 雾粒直径(选填“大于”或“小于”);
(3)垂直方向出现逆温,是指低空空气密度大,所以不容易上升;
(4)请提出一种减轻雾霾天气的方法减少开私家车出行,多乘坐公共交通工具.
分析 (1)物质由气态变为液态的过程叫液化;
(2)PM2.5是指大气中直径小于或等于2.5μm的颗粒物,也称为可入肺颗粒物;
(3)垂直方向出现逆温.高空的气温比低空气温更高的逆温现象,不易形成风,使空气中悬浮微粒难以向高空飘散而阻滞在低空和近地面;
(4)绿色出行、公交车出行、低碳生活等可有效抑制雾霾.
解答 解:(1)雾是空气中的水蒸气遇冷液化形成的;
(2)PM2.5的颗粒物直径:2.5um=2.5×10-6m=2.5×10-3mm=0.0025mm<0.03mm;
(3)垂直方向出现逆温.高空的气温比低空气温更高的逆温现象,低空空气密度大;
(4)减少PM2.5的颗粒物的排放,抑制雾霾的有效途径:浸在焚烧秸秆、提倡绿色出行.
故答案为:(1)液化;(2)小于;(3)大;(4)减少开私家车出行,多乘坐公共交通工具.
点评 本题考查物体变化及对霾的了解,霾是指空气中的灰尘、硫酸、有机碳氢化合物等颗粒物使大气浑浊的现象.“低碳减排、绿色生活”这一主题是人类社会热点问题,也是中考的热点,我们每个公民都应该从自己做起,用低碳生活理念指导自己的生活.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
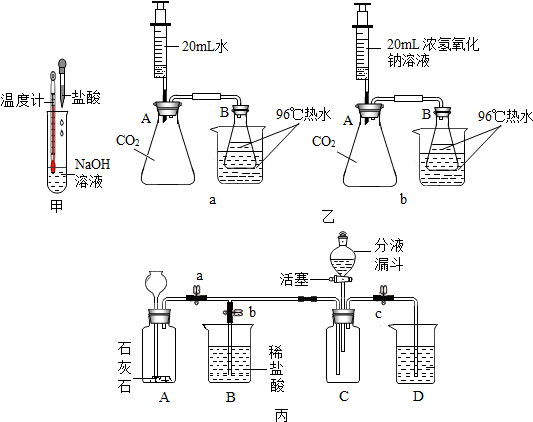
9.实验室现要配制溶质的质量分数为10%的氯化钠溶液50克,下列实验操作会使称量或测量得到的数值偏小的是( )
| A. | 用砝码已生锈的天平称量固体药品 | |
| B. | 用湿润的pH试纸测量稀盐酸的pH | |
| C. | 称量时砝码已等于药品质量、游码未归零 | |
| D. | 用量筒量取45ml液体时,俯视读数,实际量取液体的体积 |
10.聪聪同学在实验室帮老师整理废弃药品时发现一瓶没有标签的绿色粉末,对其组成很好奇.征得老师允许后,设计了如表实验进行探究.将表格填写完整.
为了进一步确定该物质的元素组成,查阅部分资料后,他继续进行了实验.
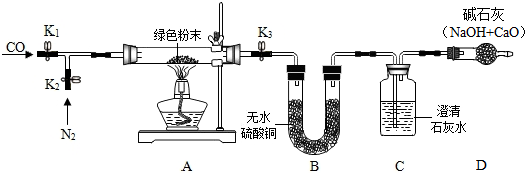
【实验步骤】
①如图搭建实验仪器,并检验装置的气密性.
②在A装置中装入11.1g绿色粉末.关闭K1,打开K2、K3,持续通入适量N2.
③关闭K2、K3,分别称量装置B、C、D的质量,记录数据.
④打开K3,点燃酒精灯加热绿色粉末直至装置C中无气泡产生时,关闭K3,熄灭酒精灯.分别称量装置B、C、D的质量,记录数据.
⑤待A冷却后,打开K1、K3,持续通入适量CO,再次点燃酒精灯加热
⑥当A中粉末全部变红后,熄灭酒精灯.试管冷却后,关闭K1.称量装置A、B、C、D的质量.
【实验现象和数据处理】
【实验分析与反思】
老师看了实验方案后认为,从环保的角度来看,此装置有一个缺陷,建议装置D后还应添加一个酒精灯,并在实验步骤⑤(填实验步骤的序号)中点燃.
(2)步骤②通入氮气的目的是将试管内的空气排尽,避免空气中的水蒸气和二氧化碳影响实验
【实验结论】
该绿色粉末的化学式为Cu2(OH)2CO3.
| 操作步骤 | 实验现象 | 结论或化学反应方程式 |
| 取少量样品于试管中,加入足量稀硫酸,将试管用导管与澄清石灰水相连. | ①产生大量气体,使澄清石灰水变浑浊. ②样品全部溶解,溶液呈蓝色. | ①样品中含有CO32-离子 ②样品中含有Cu2+离子 |
| 在上述蓝色溶液中,插入一根洁净的铁丝. | ①铁丝表面产生少量气泡. ②同时铁丝表面出现红色物质. | 写出②中的反应方程式Fe+CuSO4=Cu+FeSO4 |

【实验步骤】
①如图搭建实验仪器,并检验装置的气密性.
②在A装置中装入11.1g绿色粉末.关闭K1,打开K2、K3,持续通入适量N2.
③关闭K2、K3,分别称量装置B、C、D的质量,记录数据.
④打开K3,点燃酒精灯加热绿色粉末直至装置C中无气泡产生时,关闭K3,熄灭酒精灯.分别称量装置B、C、D的质量,记录数据.
⑤待A冷却后,打开K1、K3,持续通入适量CO,再次点燃酒精灯加热
⑥当A中粉末全部变红后,熄灭酒精灯.试管冷却后,关闭K1.称量装置A、B、C、D的质量.
【实验现象和数据处理】
| 装置A | 装置B | 装置C | 装置D | |
| 第一次 加热后 | 绿色粉末变为黑色 | 白色粉末变蓝色 质量增加0.9g | 出现白色沉淀, 质量增加2.2g | 无明显变化 质量不改变 |
| 第二次 加热后 | 黑色粉末变红色 质量为6.4g | 无明显变化, 质量不改变 | 沉淀先增加后部分溶解; 质量增加 | 无明显变化 质量不改变 |
老师看了实验方案后认为,从环保的角度来看,此装置有一个缺陷,建议装置D后还应添加一个酒精灯,并在实验步骤⑤(填实验步骤的序号)中点燃.
(2)步骤②通入氮气的目的是将试管内的空气排尽,避免空气中的水蒸气和二氧化碳影响实验
【实验结论】
该绿色粉末的化学式为Cu2(OH)2CO3.
14.丰富的化学知识能帮助你识别“假冒商品”,下列识别“假冒商品”的方法错误的是( )
| 选项 | A | B | C | D |
| 假冒商品 | 用合成纤维假冒纯棉材料 | 用氯化铵假冒尿素 | 用蒸馏水假冒苏打水 | 用锌铜合金假冒纯金 |
| 识别方法 | 灼烧,观察灼烧后的剩余物 | 与氢氧化钠混合研磨,闻是否有气味 | 用pH试纸测pH | 观察颜色 |
| A. | A | B. | B | C. | C | D. | D |