题目内容
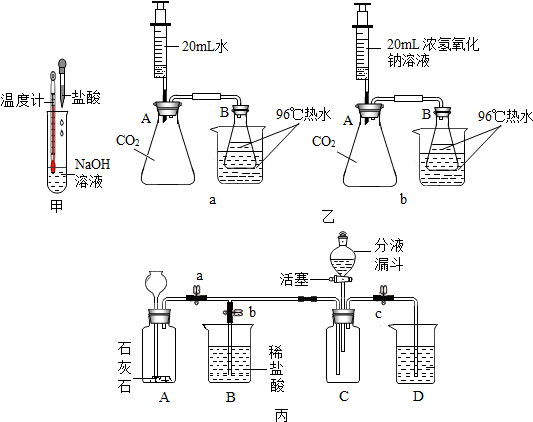
4.NaOH与CO2反应及NaOH与HCl反应均无现象,那么反应能否真的发生呢?对于这种无现象的反应能不能设计出一些实验,使反应产生一些现象,从而直观地证明两者发生了反应.某校科学兴趣小组同学就证明NaOH能否分别与CO2、HCl发生反应问题设计了多个实验方案.【实验设计1】小组一就验证NaOH能否与HCl反应问题设计了实验,如图甲所示.在试管中加入氢氧化钠溶液,再逐滴加入稀盐酸,发现温度计示数升高了,证明NaOH与HCl确实发生了反应.反应后溶液中所含溶质的可能组成有氯化钠或氯化钠和氢氧化钠或氯化钠和氯化氢.
【实验设计2】:小组二就验证NaOH能否与CO2反应问题设计了实验,如图乙所示.锥形瓶A中盛满CO2气体,锥形瓶B盛有96℃但未沸腾的热水,烧杯中加入同样温度的热水(起保持锥形瓶B中水温恒定的作用).将两套装置中注射器内的液体同时注入A中,a图中观察不到明显现象,b图中观察到B瓶中的水沸腾了,可以证明CO2能与NaOH发生反应.该实验设计中涉及了哪些科学方法对比试验和控制变量法.(至少写出两种)
【实验设计3】:小组三同学经过交流与讨论,认为可以利用与小组二不同的原理设计实验验证NaOH能否与CO2反应,实验设计如图丙所示.
打开止水夹a、c,关闭b,从长颈漏斗向装置A中加入足量的稀盐酸,为证明C中CO2是否收集满,D烧杯装的是澄清的石灰水.收集好二氧化碳后,关闭止水夹a、c,打开b,从分液漏斗向装置C中加入适量的氢氧化钠溶液,能证明CO2确实与NaOH发生了化学反应的现象是C中有气泡产生.
分析 【实验设计1】根据氢氧化钠和稀盐酸是否完全参与反应,还是其中一种有剩余来分析;
【实验设计2】:这两组实验形成了对比试验,也是采用了控制变量法进行探究;
【实验设计3】:二氧化碳能使澄清的石灰水变浑浊.根据二氧化碳的化学性质解答,根据压强原理进行推理.
解答 解:【实验设计1】若氢氧化钠和稀盐酸恰好完全中和,则溶液中的溶质只有氯化钠;
若氢氧化钠有剩余,则反应后所得溶液中的溶质是氯化钠和氢氧化钠;
若稀盐酸有剩余,则反应后所得溶液中的溶质为氯化钠和氯化氢;
故答案为:氯化钠或氯化钠和氢氧化钠或氯化钠和氯化氢;
【实验设计2】:乙图中ab两套装置形成了对比试验,此实验过程中也采用了控制变量法进行了实验探究;故填:对比试验;控制变量法;
【实验设计3】打开止水夹a、c,关闭b,从长颈漏斗向装置A中加入足量的稀盐酸,稀盐酸与大理石反应生成二氧化碳,C为向上排空气法收集二氧化碳,收集满后二氧化碳进入D烧杯,D中应加入澄清的石灰水,若看到D烧杯中澄清的石灰水变浑浊,证明C中二氧化碳收集满了;
收集好二氧化碳后,关闭止水夹a、c,打开b,从分液漏斗向装置C中加入适量氢氧化钠溶液,集气瓶中的二氧化碳与氢氧化钠反应,装置C中反应的化学方程式为:2NaOH+CO2=Na2CO3+H2O;
瓶中的二氧化碳与氢氧化钠反应,压强变小,B装置中的压强大,就会将烧杯内的盐酸流入C中,然后盐酸与反应生成的碳酸钠反应,生成二氧化碳,因此有气泡生成;
故填:澄清的石灰水;C中有气泡产生.
点评 本题能很好的考查学生对知识的掌握和应用,分析、解决问题的能力,是一道不错的题目.

练习册系列答案
相关题目
12.下列做法正确的是( )
| A. | 用甲醛溶液浸泡水产品并出售 | |
| B. | 进入闲置的地窖前应先进行灯火实验 | |
| C. | 为减少白色污染可将废弃塑料就地焚烧 | |
| D. | 如果不慎将碱溶液沾到皮肤上,应立即涂上盐酸 |
16.对下列事实的解释正确的是( )
| 选项 | 事 实 | 解 释 |
| ① | 5毫升水和5毫升酒精混合后体积小于10毫升 | 分子的体积很小 |
| ② | NaOH溶液、Ca(OH)2溶液均显碱性 | 溶液 中都含有氢氧根离子 |
| ③ | O2和O3的化学性质不同 | 物质组成元素不同 |
| ④ | 浓硫酸能干燥气体 | 浓硫酸具有吸水性 |
| A. | ①②③ | B. | ②③④ | C. | ②④ | D. | ②③ |
 在1支盛有3毫升氢氧化钠稀溶液的试管里,滴加1滴酚酞试液,再向试管里逐滴加入稀硫酸,边滴边振荡,直到红色刚好褪去.
在1支盛有3毫升氢氧化钠稀溶液的试管里,滴加1滴酚酞试液,再向试管里逐滴加入稀硫酸,边滴边振荡,直到红色刚好褪去. 已知氢氧化铝是一种不溶于水的白色沉淀,能与稀盐酸反应,也能与过量的氢氧化钠溶液反应,氢氧化铝与氢氧化钠溶液反应的化学方程式为:Al(OH)3+NaOH═NaAlO2+2H2O.生成的偏酸钠(NaAlO3)可溶于水(但Mg(OH)2固体不溶于NaOH溶液.现有含AlCl3和MgCl2的混合溶液50g,向溶液中逐滴加入溶质质量分数为10%的NaOH溶液,生成沉淀质量与加入NaOH溶液质量关系如图所示:
已知氢氧化铝是一种不溶于水的白色沉淀,能与稀盐酸反应,也能与过量的氢氧化钠溶液反应,氢氧化铝与氢氧化钠溶液反应的化学方程式为:Al(OH)3+NaOH═NaAlO2+2H2O.生成的偏酸钠(NaAlO3)可溶于水(但Mg(OH)2固体不溶于NaOH溶液.现有含AlCl3和MgCl2的混合溶液50g,向溶液中逐滴加入溶质质量分数为10%的NaOH溶液,生成沉淀质量与加入NaOH溶液质量关系如图所示: