题目内容
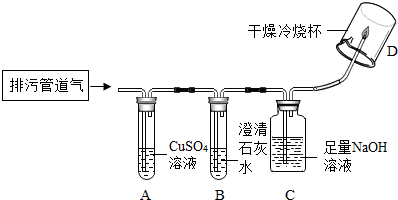
10.聪聪同学在实验室帮老师整理废弃药品时发现一瓶没有标签的绿色粉末,对其组成很好奇.征得老师允许后,设计了如表实验进行探究.将表格填写完整.| 操作步骤 | 实验现象 | 结论或化学反应方程式 |
| 取少量样品于试管中,加入足量稀硫酸,将试管用导管与澄清石灰水相连. | ①产生大量气体,使澄清石灰水变浑浊. ②样品全部溶解,溶液呈蓝色. | ①样品中含有CO32-离子 ②样品中含有Cu2+离子 |
| 在上述蓝色溶液中,插入一根洁净的铁丝. | ①铁丝表面产生少量气泡. ②同时铁丝表面出现红色物质. | 写出②中的反应方程式Fe+CuSO4=Cu+FeSO4 |
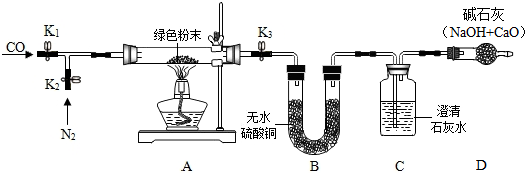
【实验步骤】
①如图搭建实验仪器,并检验装置的气密性.
②在A装置中装入11.1g绿色粉末.关闭K1,打开K2、K3,持续通入适量N2.
③关闭K2、K3,分别称量装置B、C、D的质量,记录数据.
④打开K3,点燃酒精灯加热绿色粉末直至装置C中无气泡产生时,关闭K3,熄灭酒精灯.分别称量装置B、C、D的质量,记录数据.
⑤待A冷却后,打开K1、K3,持续通入适量CO,再次点燃酒精灯加热
⑥当A中粉末全部变红后,熄灭酒精灯.试管冷却后,关闭K1.称量装置A、B、C、D的质量.
【实验现象和数据处理】
| 装置A | 装置B | 装置C | 装置D | |
| 第一次 加热后 | 绿色粉末变为黑色 | 白色粉末变蓝色 质量增加0.9g | 出现白色沉淀, 质量增加2.2g | 无明显变化 质量不改变 |
| 第二次 加热后 | 黑色粉末变红色 质量为6.4g | 无明显变化, 质量不改变 | 沉淀先增加后部分溶解; 质量增加 | 无明显变化 质量不改变 |
老师看了实验方案后认为,从环保的角度来看,此装置有一个缺陷,建议装置D后还应添加一个酒精灯,并在实验步骤⑤(填实验步骤的序号)中点燃.
(2)步骤②通入氮气的目的是将试管内的空气排尽,避免空气中的水蒸气和二氧化碳影响实验
【实验结论】
该绿色粉末的化学式为Cu2(OH)2CO3.
分析 碳酸盐能和酸反应生成二氧化碳,二氧化碳能使澄清石灰水变浑浊;
铜离子在溶液中显蓝色;
铁和硫酸铜反应生成硫酸亚铁和铜;
【实验步骤】
一氧化碳能和氧化铜反应生成铜和二氧化碳;
无水硫酸铜是白色粉末,能和水反应生成蓝色硫酸铜晶体;
澄清石灰水中的氢氧化钙能和二氧化碳反应生成碳酸钙沉淀和水;
【实验分析与反思】
一氧化碳有毒,逸散到空气在会污染环境;
【实验结论】
由实验过程可知,该绿色粉末是碱式碳酸铜.
解答 解:产生大量气体,使澄清石灰水变浑浊,说明样品中含有碳酸根离子,样品全部溶解,溶液呈蓝色,说明样品中含有铜离子,铁丝表面出现红色物质,说明铁和硫酸铜反应生成了铜和硫酸亚铁,表格填写如下表所示:
| 操作步骤 | 实验现象 | 结论或化学反应方程式 |
| 取少量样品于试管中,加入足量稀硫酸,将试管用导管与澄清石灰水相连. | ①产生大量气体,使澄清石灰水变浑浊. ②样品全部溶解,溶液呈蓝色. | ①样品中含有CO32- 离子 ②样品中含有Cu2+离子 |
| 在上述蓝色溶液中,插入一根洁净的铁丝. | ①铁丝表面产生少量气泡. ②同时铁丝表面出现红色物质. | 写出②中的反应方程式: Fe+CuSO4=Cu+FeSO4 |
⑤待A冷却后,打开K1、K3,持续通入适量CO,再次点燃酒精灯加热;
故填:打开K1、K3,持续通入适量CO,再次点燃酒精灯加热.
【实验现象和数据处理】
填表如下表所示:
| 装置A | 装置B | 装置C | 装置D | |
| 第一次 加热后 | 绿色粉末变为黑色 | 白色粉末变蓝色, 质量增加0.9g | 出现白色沉淀, 质量增加2.2g | 无明显变化 质量不改变 |
| 第二次 加热后 | 黑色粉末变红色 质量为6.4g | 无明显变化, 质量不改变 | 沉淀先增加后部分溶解; 质量增加 | 无明显变化 质量不改变 |
从环保的角度来看,此装置有一个缺陷,建议装置D后还应添加一个酒精灯,并在实验步骤⑤中点燃;
步骤②通入氮气的目的是将试管内的空气排尽,避免空气中的水蒸气和二氧化碳影响实验.
故填:⑤;将试管内的空气排尽,避免空气中的水蒸气和二氧化碳影响实验.
【实验结论】
黑色粉末变红色,质量为6.4g,说明样品中铜元素的质量是6.4g;
黑色粉末是氧化铜,铜元素质量是6.4g时,氧元素质量是1.6g;
白色粉末变蓝色,质量增加0.9g,说明生成水的质量是0.9g,则样品中氢元素质量为:0.9g×$\frac{2}{18}$×100%=0.1g;
出现白色沉淀,质量增加2.2g,说明生成二氧化碳的质量是2.2g,则样品中碳元素质量为:2.2g×$\frac{12}{44}$×100%=0.6g;
则样品中氧元素质量为:0.9g×$\frac{16}{18}$×100%=0.1g+2.2g×$\frac{32}{44}$×100%+1.6g=4g,
则样品中铜原子、氢原子、碳原子、氧原子的个数比为:$\frac{6.4g}{64}$:$\frac{0.1g}{1}$:$\frac{0.6g}{12}$:$\frac{4g}{16}$=2:2:1:3:5,
该绿色粉末是碱式碳酸铜,碱式碳酸铜的化学式为Cu2(OH)2CO3.
故填:Cu2(OH)2CO3.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

练习册系列答案
相关题目
20.在生活或实验室中区分下列各组物质的两种方法都合理的是( )
| A | B | C | D | |
| 区分的物质 | 蒸馏水和 医用酒精 | 区分黄铜和黄金 | 氢氧化钠和氢氧化钙 | 区分空气和人体呼出的气体 |
| 方案一 | 测pH | 观察颜色 | 在空气中放置一段时间后观察 | 取样,分别插入带火星木条 |
| 方案二 | 取样涂抹在皮肤上 | 取样,分别加入稀盐酸 | 加水溶解观察 | 取样,分别加入澄清石灰水 |
| A. | A | B. | B | C. | C | D. | D |
18.在下列变化中,既属于化合反应,又属于氧化反应的是( )
| A. | 用高锰酸锰制氧气 | B. | 硫粉在氧气中燃烧 | ||
| C. | 用氯酸钾和二氧化锰制氧气 | D. | 石蜡在空气中燃烧 |
20.下列各组中名称、化学式、物质类别相一致的是( )
| A. | 氯化铁、FeCl2、盐 | B. | 干冰、CO2、氧化物 | C. | 生石灰、CaCO3、盐 | D. | 纯碱、NaOH、碱 |
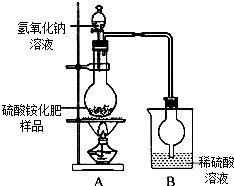 硫酸铵是常用的一种氮肥,现有一种硫酸铵化肥,为测定其中硫酸铵的质量分数,采用如图(甲)所示的装置进行实验.已知在A、B中所发生反应的化学方程式如下:(NH4)2SO4+2NaOH$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+2H2O+Na2SO4 2NH3+H2SO4═(NH4)2SO4(注:反应生成的NH3能被烧杯中的稀硫酸溶液完全吸收)
硫酸铵是常用的一种氮肥,现有一种硫酸铵化肥,为测定其中硫酸铵的质量分数,采用如图(甲)所示的装置进行实验.已知在A、B中所发生反应的化学方程式如下:(NH4)2SO4+2NaOH$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+2H2O+Na2SO4 2NH3+H2SO4═(NH4)2SO4(注:反应生成的NH3能被烧杯中的稀硫酸溶液完全吸收)