题目内容
11.煤等不清洁的能源的大量使用,是我国雾霾产生的最根本的原因.(1)某锅炉用煤做燃料,每天燃烧含硫2%的煤4.8×103kg.该锅炉的烟尘中每天排放到空气中的二氧化硫为多少千克?
(2)为测定烟尘中二氧化硫的含量,技术上可根据下列反应测定:SO2+I2+2H2O═H2SO4+2HI.现取该厂废气样品500mL,用含碘4×10-4mg的碘溶液与烟尘中二氧化硫恰好完全反应,试计算该厂排放的烟尘是否符合国家规定的工业废气排放标准?(烟尘中二氧化硫的含量不得超过0.15mg/m3,结果保留2位小数)
(3)对煤炭加工和对烟尘除硫都是解决大气污染的途径.某企业以Mg(OH)2饱和液经泵打入吸收塔与烟气充分接触,使烟气中的二氧化硫与浆液中的Mg(OH)2进行反应生成MgSO3,此法的脱硫效率可达到95%以上.用100kg质量分数为5.8%的Mg(OH)2饱和液,理论上可吸收SO2多少千克?
分析 (1)根据煤的质量及其硫的质量分数可以计算一定量的煤中含有二氧化硫的质量;硫燃烧生成二氧化硫,根据硫的质量可以计算二氧化硫的质量;
(2)通过计算排放的废气中二氧化硫的含量,可以判断排放的废气是否符合国家规定的工业废气排放标准;
(3)根据氢氧化镁的质量求出二氧化硫的质量即可.
解答 解:(1)设每天该厂排放到空气中的二氧化硫的质量为x,
4800kg煤中硫的质量为:4800kg×2%=96kg,
S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2
32 64
96kg x
$\frac{32}{96kg}=\frac{64}{x}$
x=192kg
答:每天该厂排放到空气中的二氧化硫质量为192kg.
(2)解:设500mL废气样品中二氧化硫的质量为y,
SO2+2H2O+I2═H2SO4+2HI,
64 254
y 4×10-4mg
$\frac{64}{y}=\frac{254}{4×1{0}^{-4}mg}$
x=1.0×10-4mg,
该厂排放的废气中,二氧化硫的浓度为:1.0×10-4mg÷500mL=0.20mg/m3,
因为0.20mg/m3>0.15mg/m3,所以该厂排放的废气不符合国家规定的工业废气排放标准;
(3)设理论上可吸收SO2的质量为z.
Mg(OH)2+SO2=MgSO3+H2O
58 64
100kg×5.8% z
$\frac{58}{100kg×5.8%}=\frac{64}{z}$
z=6.4kg
答:理论上可吸收SO2的质量为6.4kg.
点评 本题比较简单,主要考查学生运用假设法和化学方程式进行计算和推断的能力,由于数据比较复杂,要注意计算的准确性.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
6.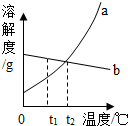 下表列出了硝酸钾在不同温度下的溶解度.
下表列出了硝酸钾在不同温度下的溶解度.
(1)从上表你可以得到什么信息(写一条即可)?硝酸钾的溶解度随温度的升高而增大(写一条即可).硝酸钾的溶解度曲线与图中曲线a(选填“a”或“b”)相吻合.
(2)60℃时,硝酸钾饱和溶液中溶质与溶剂的质量比为11:10;欲使该温度时一定量的硝酸钾不饱和溶液变为饱和溶液,可采取的措施是增加溶质.
(3)将t2℃a、b两种物质的饱和溶液降温至t1℃,溶液中溶质质量分数不变的是b.
 下表列出了硝酸钾在不同温度下的溶解度.
下表列出了硝酸钾在不同温度下的溶解度. | 温度(℃) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 溶解度(g) | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | 169 |
(2)60℃时,硝酸钾饱和溶液中溶质与溶剂的质量比为11:10;欲使该温度时一定量的硝酸钾不饱和溶液变为饱和溶液,可采取的措施是增加溶质.
(3)将t2℃a、b两种物质的饱和溶液降温至t1℃,溶液中溶质质量分数不变的是b.
16.对下列事实的解释正确的是( )
| 选项 | 事 实 | 解 释 |
| ① | 5毫升水和5毫升酒精混合后体积小于10毫升 | 分子的体积很小 |
| ② | NaOH溶液、Ca(OH)2溶液均显碱性 | 溶液 中都含有氢氧根离子 |
| ③ | O2和O3的化学性质不同 | 物质组成元素不同 |
| ④ | 浓硫酸能干燥气体 | 浓硫酸具有吸水性 |
| A. | ①②③ | B. | ②③④ | C. | ②④ | D. | ②③ |
3.下列化学反应属于分解反应的是( )
| A. | S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2 | B. | CO2+H2O═H2CO3 | ||
| C. | 2C2H2+5O2$\frac{\underline{\;点燃\;}}{\;}$4CO2+2H2O | D. | Ca(HCO3)2═CaCO3↓+CO2↑+H2O |
20.下列各组中名称、化学式、物质类别相一致的是( )
| A. | 氯化铁、FeCl2、盐 | B. | 干冰、CO2、氧化物 | C. | 生石灰、CaCO3、盐 | D. | 纯碱、NaOH、碱 |
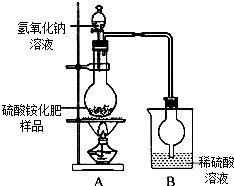 硫酸铵是常用的一种氮肥,现有一种硫酸铵化肥,为测定其中硫酸铵的质量分数,采用如图(甲)所示的装置进行实验.已知在A、B中所发生反应的化学方程式如下:(NH4)2SO4+2NaOH$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+2H2O+Na2SO4 2NH3+H2SO4═(NH4)2SO4(注:反应生成的NH3能被烧杯中的稀硫酸溶液完全吸收)
硫酸铵是常用的一种氮肥,现有一种硫酸铵化肥,为测定其中硫酸铵的质量分数,采用如图(甲)所示的装置进行实验.已知在A、B中所发生反应的化学方程式如下:(NH4)2SO4+2NaOH$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+2H2O+Na2SO4 2NH3+H2SO4═(NH4)2SO4(注:反应生成的NH3能被烧杯中的稀硫酸溶液完全吸收) 自制泡菜,卫生有保障,原料配比随意.但也有不尽人意之处,即保存时间稍长,味道变酸,剌激肠胃.
自制泡菜,卫生有保障,原料配比随意.但也有不尽人意之处,即保存时间稍长,味道变酸,剌激肠胃.