题目内容
4.下列物质的变化与空气的成分无关的是( )| A. | 浓硫酸暴露在空气中,溶液的质量会变大 | |
| B. | 铝丝表面形成致密的保护膜 | |
| C. | 浓盐酸敞口放置,溶质的质量分数会变小 | |
| D. | 生石灰暴露在空气中会变质 |
分析 根据浓硫酸、铝丝、浓盐酸以及氧化钙的物理性质与化学性质进行分析判断即可.
解答 解:A、浓硫酸具有吸水性,放置在空气中会吸水水蒸气而导致溶质质量增加,发生的变化与空气中成分有关.
B、铝的化学性质比较活泼,能与空气中的氧气反应生成致密的保护膜,发生的变化与空气中成分有关.
C、浓盐酸具有挥发性,放置在空气中会挥发出氯化氢气体而导致溶质质量减少,发生的变化与空气中成分无关.
D、生石灰敞口放置在空气中,易吸收空气中的水分而质量增加,与空气中成分有关.
故选:C.
点评 本题难度不大,熟练掌握浓硫酸、浓盐酸、铝丝以及生石灰的性质等并能灵活运用是正确解答此类题的关键.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
9. 在师生联谊晚会上,化学老师表演了“滴水生火”和“吹气生火”的魔术.用棉花将一些过氧化钠(Na2O2)包裹其中,用胶头滴管向棉花团中滴水,稍后棉花团剧烈燃烧起来.接着再用棉花将一些过氧化钠包裹其中,用一根玻璃导管向棉花团中吹气,稍后棉花团也剧烈燃烧起来.同学们很感兴趣,下课后,化学兴趣小组的同学对燃烧原因及一瓶白色过氧化钠固体的变质情况进行了如下探究.
在师生联谊晚会上,化学老师表演了“滴水生火”和“吹气生火”的魔术.用棉花将一些过氧化钠(Na2O2)包裹其中,用胶头滴管向棉花团中滴水,稍后棉花团剧烈燃烧起来.接着再用棉花将一些过氧化钠包裹其中,用一根玻璃导管向棉花团中吹气,稍后棉花团也剧烈燃烧起来.同学们很感兴趣,下课后,化学兴趣小组的同学对燃烧原因及一瓶白色过氧化钠固体的变质情况进行了如下探究.
【查阅资料】①过氧化钠是一种淡黄色固体 ②过氧化钠能与水反应,生成氢氧化钠和氧气 ③过氧化钠能与二氧化碳反应,生成碳酸钠和氧气
【分析讨论】
(1)根据棉花团剧烈燃烧的现象分析,反应中除了生成氧气外,还说明过氧化钠发生的反应是放热(填“吸热”或“放热”)反应.
(2)小陈同学认为从物理性质角度看该样品中肯定不含过氧化钠,他的理由是过氧化钠为淡黄色,但小李同学觉得不可靠,他取了一些样品加入适量的水,观察到不产生气泡(填现象),证明了小陈同学的判断是正确的.
【猜想假设】
猜想一:样品中只有NaOH
猜想二:样品中含有Na2CO3和NaOH
猜想三:样品中只含Na2CO3
【实验探究】
为了证明以上猜想,甲乙丙三个同学利用小李同学所得的溶液,分别进行了如下三个实验方案的探究:
(1)上述实验方案中,实验操作、现象和结论都正确的是丙(填序号).
(2)实验操作中存在的错误是将pH试纸直接浸入溶液中测pH.
(3)实验方案中也有错误,请说出有错误的实验方案以及错误的原因甲实验不正确,因为碳酸钠溶液也显碱性;乙实验也不正确,因为溶液中的氢氧化钠先与加入的少量盐酸反应,即使溶液中有碳酸钠也可能不产生气体.
【继续探究】
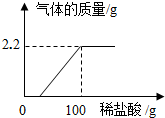
在老师的带领下,同学们称取了一定质量的样品,加入足量的水,配成了50g溶液,再向所配得的溶液中逐滴滴加溶质质量分数为7.3%的稀盐酸,并精确测量溶液的质量,根据实验数据绘制出如图所示稀盐酸的质量与生成气体质量的关系图.试计算:
(1)变质前过氧化钠的质量为7.8g;
(2)恰好完全反应时所得溶液中溶质的质量分数为7.9%.
【反思】过氧化钠保存时应该密封保存.
 在师生联谊晚会上,化学老师表演了“滴水生火”和“吹气生火”的魔术.用棉花将一些过氧化钠(Na2O2)包裹其中,用胶头滴管向棉花团中滴水,稍后棉花团剧烈燃烧起来.接着再用棉花将一些过氧化钠包裹其中,用一根玻璃导管向棉花团中吹气,稍后棉花团也剧烈燃烧起来.同学们很感兴趣,下课后,化学兴趣小组的同学对燃烧原因及一瓶白色过氧化钠固体的变质情况进行了如下探究.
在师生联谊晚会上,化学老师表演了“滴水生火”和“吹气生火”的魔术.用棉花将一些过氧化钠(Na2O2)包裹其中,用胶头滴管向棉花团中滴水,稍后棉花团剧烈燃烧起来.接着再用棉花将一些过氧化钠包裹其中,用一根玻璃导管向棉花团中吹气,稍后棉花团也剧烈燃烧起来.同学们很感兴趣,下课后,化学兴趣小组的同学对燃烧原因及一瓶白色过氧化钠固体的变质情况进行了如下探究.【查阅资料】①过氧化钠是一种淡黄色固体 ②过氧化钠能与水反应,生成氢氧化钠和氧气 ③过氧化钠能与二氧化碳反应,生成碳酸钠和氧气
【分析讨论】
(1)根据棉花团剧烈燃烧的现象分析,反应中除了生成氧气外,还说明过氧化钠发生的反应是放热(填“吸热”或“放热”)反应.
(2)小陈同学认为从物理性质角度看该样品中肯定不含过氧化钠,他的理由是过氧化钠为淡黄色,但小李同学觉得不可靠,他取了一些样品加入适量的水,观察到不产生气泡(填现象),证明了小陈同学的判断是正确的.
【猜想假设】
猜想一:样品中只有NaOH
猜想二:样品中含有Na2CO3和NaOH
猜想三:样品中只含Na2CO3
【实验探究】
为了证明以上猜想,甲乙丙三个同学利用小李同学所得的溶液,分别进行了如下三个实验方案的探究:
| 序号 | 实验操作 | 实验现象 | 结论 |
| 甲 | 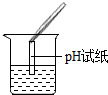 | 试纸变色,对比比色卡,pH>7 | 样品中一定含NaOH |
| 乙 | 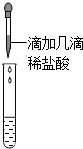 | 没有气体产生 | 样品中一定不含Na2CO3 |
| 丙 | 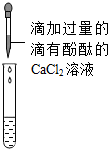 | 产生沉淀,且溶液变成红色 | 样品中含Na2CO3和NaOH |
(2)实验操作中存在的错误是将pH试纸直接浸入溶液中测pH.
(3)实验方案中也有错误,请说出有错误的实验方案以及错误的原因甲实验不正确,因为碳酸钠溶液也显碱性;乙实验也不正确,因为溶液中的氢氧化钠先与加入的少量盐酸反应,即使溶液中有碳酸钠也可能不产生气体.
【继续探究】
在老师的带领下,同学们称取了一定质量的样品,加入足量的水,配成了50g溶液,再向所配得的溶液中逐滴滴加溶质质量分数为7.3%的稀盐酸,并精确测量溶液的质量,根据实验数据绘制出如图所示稀盐酸的质量与生成气体质量的关系图.试计算:
(1)变质前过氧化钠的质量为7.8g;
(2)恰好完全反应时所得溶液中溶质的质量分数为7.9%.
【反思】过氧化钠保存时应该密封保存.
 如图是水发生变化的微观结构模型.
如图是水发生变化的微观结构模型.



 ”构成的物质浓度越大,反应速率越快的微观原因是氧气的浓度越大,单位体积内氧分子的个数越多,与一氧化碳分子结合生成二氧化碳分子的个数越多,因此反应速率越快.
”构成的物质浓度越大,反应速率越快的微观原因是氧气的浓度越大,单位体积内氧分子的个数越多,与一氧化碳分子结合生成二氧化碳分子的个数越多,因此反应速率越快.


 如图中的物质分别代表初中化学中常见的物质.已知B、C、D、E为气体,G是大理石的主要成分.它们转化关系如下:
如图中的物质分别代表初中化学中常见的物质.已知B、C、D、E为气体,G是大理石的主要成分.它们转化关系如下: