题目内容
14. 金属用途广泛,其结构和性质等是化学的重要研究内容.
金属用途广泛,其结构和性质等是化学的重要研究内容.(1)如图
 是铝的原子结构示意图.下列说法不正确的是C.
是铝的原子结构示意图.下列说法不正确的是C.A.铝原子的质子数为13B.在化合物中铝通常显+3价
C.铝是地壳中含量最多的元素D.铝可作导线是由于它具有良好的导电性
(2)某化学小组用一定量AgNO3和Cu(NO3)2混合溶液进行了如图实验,并对溶液A和固体B的成分进行
了分析和实验探究.
【提出问题】溶液A中的溶质可能有哪些?
【作出猜想】①只有Zn(NO3)2 ②有Zn (NO3)2、AgNO3
③有Zn (NO3)2、Cu(NO3)2 ④有Zn (NO3)2、AgNO3、Cu(NO3)2
【交流讨论】不合理的猜想是②(填标号).
【实验探究】若猜想①成立,通过以下实验可确定固体B的成分,请将下表填写完整.
| 实验步骤 | 现 象 | 有关反应的化学方程式 |
| 取少量固体B,滴加稀盐酸. | 有气泡产生 | Zn+2HCl=ZnCl2+H2↑. |
分析 (1)依据原子结构示意图的意义以及核外电子的得失规律和铝的有关性质分析解答;
(2)根据金属活动性顺序及其运用分析.排在氢之前的金属可与稀盐酸或稀硫酸反应产生氢气,排在前面的金属(除钾、钙、钠外)可将排在后面的金属从其盐溶液中置换出来.
解答 解:(1)A、根据原子结构示意图的特点可知:铝的核内质子数为13,故A正确;
B、根据原子的核外电子在化学反应中的规律特点可知:铝的最外层电子数是3,且在化学反应中易失掉3个电子而达到稳定结构,故B正确;
C、依据地壳中元素的含有情况可知,铝是地壳中含量最多的金属元素,而含量最多的元素是氧;故C错误;
D、根据金属铝的性质可知:铝具有较好的导电性,所以可以用铝制作导线;故D正确;
故选C;
(2)由金属活动性顺序及其运用可知,向AgNO3和Cu(NO3)2混合溶液中加入锌粉,Zn应先与AgNO3反应后与Cu(NO3)2反应,由于锌粉量的不同,溶液A中的溶质不同,溶液中的溶质可能是:只有Zn(NO3)2或Zn (NO3)2、Cu(NO3)2 或Zn (NO3)2、AgNO3、Cu(NO3)2.由以上分析可知,
[交流讨论]不合理的是②;理由是:Zn应先与AgNO3反应后与Cu(NO3)2反应,当有AgNO3剩余时,溶质中一定含有Cu(NO3)2;
[实验探究]当锌粉过量时,溶液中的溶质只有Zn(NO3)2,固体B中有锌,当加入酸时有气泡生成,故下表为:
| 实验步骤 | 现象 | 有关反应的化学方程式 |
| 稀盐酸(或稀硫酸等) | Zn+2HCl=ZnCl2+H2↑ (或Zn+H2SO4=ZnSO4+H2↑) |
点评 本题难度不是很大,主要考查了对金属活动性顺序的应用和理解,培养学生的应用能力和解决问题的能力.

练习册系列答案
相关题目
4.同学们整理实验室时,发现一瓶白色固体粉末状药品.实验老师告诉大家药品可能是碳酸钠、碳酸钙、氯化钠、氢氧化钠、硫酸钡中的一种或几种.同学们对此很好奇,于是他们对这瓶白色粉末的成分做了如下探究.
【实验I】小伟取一定量白色粉末于烧杯中,加足量水搅拌,过滤,得到固体和无色滤液.
【实验II】小伟取少量实验I得到的无色滤液于试管中,滴加无色酚酞后,观察到变成红色.于是小伟马上就得出结论,该瓶白色粉末一定有氢氧化钠.但是小旭却认为小伟的结论不一定正确,你认为小旭的理由是(1)碳酸钠的溶液也为碱性.于是小旭另取少量滤液于试管中,加入过量氯化钡溶液,有白色沉淀产生;取上层清液,加入少量氯化铁溶液产生红褐色沉淀.
根据现象,你认为滤液中的溶质有(2)NaOH、Na2CO3,(填化学式,下同)请用相关化学方程式解释这些现象(3)BaCl2+Na2CO3=BaCO3↓+2NaCl;
3NaOH+FeCl3═Fe(OH)3↓+3NaCl.
【实验III】小伟和小旭认为有必要再对实验I中滤渣的成分进行探究,过程如下:
【交流】实验结束后,同学们一致认为通过实验Ⅱ能确定原试剂瓶中还含有(4)NaOH、Na2CO3,但小伟和小旭同学认为,通过上述实验还是不能证明原瓶中是否含有(5NaCl.
【实验I】小伟取一定量白色粉末于烧杯中,加足量水搅拌,过滤,得到固体和无色滤液.
【实验II】小伟取少量实验I得到的无色滤液于试管中,滴加无色酚酞后,观察到变成红色.于是小伟马上就得出结论,该瓶白色粉末一定有氢氧化钠.但是小旭却认为小伟的结论不一定正确,你认为小旭的理由是(1)碳酸钠的溶液也为碱性.于是小旭另取少量滤液于试管中,加入过量氯化钡溶液,有白色沉淀产生;取上层清液,加入少量氯化铁溶液产生红褐色沉淀.
根据现象,你认为滤液中的溶质有(2)NaOH、Na2CO3,(填化学式,下同)请用相关化学方程式解释这些现象(3)BaCl2+Na2CO3=BaCO3↓+2NaCl;
3NaOH+FeCl3═Fe(OH)3↓+3NaCl.
【实验III】小伟和小旭认为有必要再对实验I中滤渣的成分进行探究,过程如下:
| 步骤 | 实验现象 |
| (1)取少量液于试管,向其滴加足量稀盐酸溶液,振荡 | 有气体冒出,试管底还残留少量固体 |
| (2)过滤,取少量滤液于试管中,加入硝酸银和稀硝酸溶液 | 有白色沉淀生成 |
2.下列说法正确的是( )
| A. | 淀粉遇加碘食盐溶液会变蓝 | |
| B. | 瘦肉中主要含蛋白质,不含无机盐之类的营养素 | |
| C. | 某气体能使灼热的氧化铜还原成铜,这种气体一定是一氧化碳 | |
| D. | 鉴别氢氧化钠固体和硝酸铵固体,可加适量水溶解,用手触摸试管外壁温度的变化 |
6.酒精灯火焰太小时,将灯芯拨得松散些,可使火焰更旺.其原理是( )
| A. | 增加可燃物的浓度 | B. | 提高可燃物的着火点 | ||
| C. | 增加空气中氧气含量 | D. | 增大可燃物与空气的接触面 |
3.我区某校九年级(1)班的同学们学习“中和反应”后,在实验室里他们将一定量的稀硫酸滴到氢氧化钠溶液中,如图1所示,其反应的化学方程式为H2SO4+2NaOH═Na2SO4+2H2O.
同学们发现该实验观察不到明显的现象,于是进行了一系列探究活动: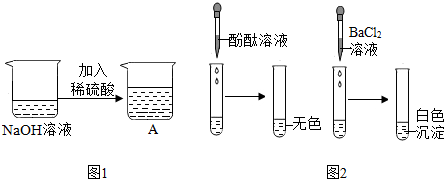
【提出问题】如何验证该反应已经发生?
【实验探究】甲组同学分别取图1所示A烧杯中的溶液进行了两个探究活动(实验1和实验2),现象如图2所示.
【反思评价】甲组同学认为图2中“实验1”能验证反应已经发生了,他们的理由是加入酚酞试液不变色.
【再次提问】图1所示A烧杯中溶液的溶质成分有哪些?
【再次探究】乙组同学进行如下实验,已知他们所加入试剂的类别不同于“实验1”和“实验2”所加试剂的类别.请填空:
【解释与结论】
将“实验2”中烧杯静置一段时间后,上层清液中一定有的溶质是NaCl.(填化学式)
同学们发现该实验观察不到明显的现象,于是进行了一系列探究活动:

【提出问题】如何验证该反应已经发生?
【实验探究】甲组同学分别取图1所示A烧杯中的溶液进行了两个探究活动(实验1和实验2),现象如图2所示.
【反思评价】甲组同学认为图2中“实验1”能验证反应已经发生了,他们的理由是加入酚酞试液不变色.
【再次提问】图1所示A烧杯中溶液的溶质成分有哪些?
【再次探究】乙组同学进行如下实验,已知他们所加入试剂的类别不同于“实验1”和“实验2”所加试剂的类别.请填空:
| 实验操作 | 实验现象 | 结论 |
| 取A烧杯中的少量溶液于试管中,加入铁粉. | 观察到有气泡产生 | A烧杯中溶液的溶质是Na2SO4和H2SO4. |
将“实验2”中烧杯静置一段时间后,上层清液中一定有的溶质是NaCl.(填化学式)
 某同学为了检验家里购买的硫酸铵化肥是否合格,他称取27.5g化肥样品与足量浓烧碱溶液加热,产生的氨气用100.0g废硫酸完全吸收.测得吸收氨气后溶液总质量m与反应时间t的变化如图所示.所涉及的反应为:
某同学为了检验家里购买的硫酸铵化肥是否合格,他称取27.5g化肥样品与足量浓烧碱溶液加热,产生的氨气用100.0g废硫酸完全吸收.测得吸收氨气后溶液总质量m与反应时间t的变化如图所示.所涉及的反应为: