题目内容
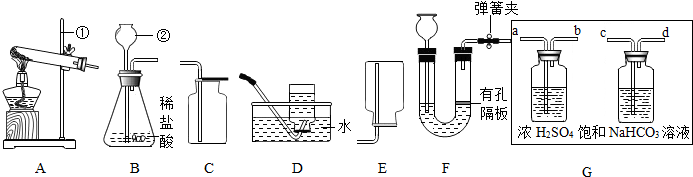
2.小亮同学设计如图装置来制取并收集气体,你认为他能制得的气体是( )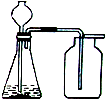
| A. | 用KMnO4粉末制取O2 | |
| B. | 用KClO3和MnO2制取O2 | |
| C. | 用Zn(固体)和稀硫酸制(液体)取H2 (密度比空气小,难溶于水) | |
| D. | 用石灰石(固体)和稀盐酸(液体)制取CO2(密度比空气大,溶于水) |
分析 A、根据高锰酸钾制取氧气的反应条件考虑;
B、根据氯酸钾制取氧气的反应条件考虑;
C、根据氢气的收集方法考虑;
D、根据二氧化碳的制取方法和收集方法考虑.
解答 解:A、用高锰酸钾粉末制取氧气的反应条件是加热,该装置没有酒精灯,故A错;
B、用氯酸钾和二氧化锰制取氧气的反应条件是加热,该装置没有酒精灯,故B错;
C、氢气的密度比空气小,排空气法收集氢气的方法是向下排空气法,图示是向上排空气法,故C错;
D、石灰石和稀盐酸制取二氧化碳,反应物是固体和液体不需要加热,由于二氧化碳能溶于水,不能用排水法收集,密度比空气大,可以用向上排空气法收集,故D正确.
故选D.
点评 制取气体的反应物的状态是固体和液体,不需要加热,如果固体与固体反应制取气体需要加热,收集方法的选择依据:难溶于水或不易溶于水用排水法收集,密度比空气大用向上排空气法收集,密度比空气小用向下排空气法收集.

练习册系列答案
相关题目
10.氢氧化钠是一种重要的化工原料,也是实验室中常见的一种试剂,氢氧化钠必须密封保存,因为易与空气中二氧化碳发生化学反应而变质,用化学方程式表示变质原因2NaOH+CO2═Na2CO3+H2O.
下面是几位同学对一瓶氢氧化钠固体成分进行的探究:
探究一:确定一瓶氢氧化钠固体是否变质
小强方案:
探究二:确定氢氧化钠固体变质的程度
小刚方案:
小刚实验方案中滴入过量的CaCl2溶液目的是全部除去溶液中的Na2CO3
探究三:定量分析部分变质的氢氧化钠固体中氢氧化钠的含量
1、下面是小明和小军两位同学不同的设计实验方案:

通过小明实验方案计算出样品中氢氧化钠的含量(写出计算过程)
2、小军实验步骤如下
①检查好装置气密性,装好药品后连接并固定好装置
②打开弹簧夹a,通入一段时间的空气,再称量D装置质量记录为100g
③关闭弹簧夹a,打开B装置中的分液漏斗,滴入稀硫酸,直到瓶内无气泡产生.
④打开弹簧夹a,继续通入一段时间空气,再称量D装置质量记录为102.2g
…
实验分析:
(1)在小军实验中A装置作用是除去空气中的CO2,防止其被D吸收,
(2)实验步骤④中,继续通入一段时间空气的目的是将反应生成的CO2全部排出被D吸收,
(3)如果缺装置C,最终所测得氢氧化钠的含量将会偏低(填“偏高”、“不变”、或者“偏低”)
下面是几位同学对一瓶氢氧化钠固体成分进行的探究:
探究一:确定一瓶氢氧化钠固体是否变质
小强方案:
| 实验操作 | 实验现象 | 结论 |
| 取少量样品于试管中,加入一定量水,样品全溶解后,滴加足量的稀盐酸(稀硫酸)(填一种溶液名称) | 有气泡产生 | 氢氧化钠已变质 |
小刚方案:
| 实验操作 | 实验现象 | 结论 |
| ①取少量样品于试管中,加入一定量水后,样品全溶解后,滴加过量的CaCl2溶液 | 产生白色沉淀 | 氢氧化钠固体部分 变质 |
| ②静置后取上层清液于试管中,滴入2滴酚酞试液 | 溶液变红 |
探究三:定量分析部分变质的氢氧化钠固体中氢氧化钠的含量
1、下面是小明和小军两位同学不同的设计实验方案:

通过小明实验方案计算出样品中氢氧化钠的含量(写出计算过程)
2、小军实验步骤如下
①检查好装置气密性,装好药品后连接并固定好装置
②打开弹簧夹a,通入一段时间的空气,再称量D装置质量记录为100g
③关闭弹簧夹a,打开B装置中的分液漏斗,滴入稀硫酸,直到瓶内无气泡产生.
④打开弹簧夹a,继续通入一段时间空气,再称量D装置质量记录为102.2g
…
实验分析:
(1)在小军实验中A装置作用是除去空气中的CO2,防止其被D吸收,
(2)实验步骤④中,继续通入一段时间空气的目的是将反应生成的CO2全部排出被D吸收,
(3)如果缺装置C,最终所测得氢氧化钠的含量将会偏低(填“偏高”、“不变”、或者“偏低”)

 属于单质(填“单质”或“化合物”).
属于单质(填“单质”或“化合物”).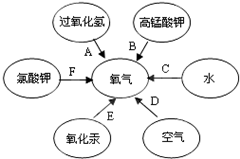 有六种途径可以制得氧气,如图所示:
有六种途径可以制得氧气,如图所示: 二氧化锰和硫酸铜溶液都可作为过氧化氢分解的催化剂.在一节化学实验课上,小花同学向10g过氧化氢中加入1.65g溶质质量分数为10%的硫酸铜溶液.实验过程中溶液总质量与反应时间的关系如图所示.求:
二氧化锰和硫酸铜溶液都可作为过氧化氢分解的催化剂.在一节化学实验课上,小花同学向10g过氧化氢中加入1.65g溶质质量分数为10%的硫酸铜溶液.实验过程中溶液总质量与反应时间的关系如图所示.求: