题目内容
5.过氧化钙(CaO2)是一种重要化工试剂,可用于改善水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等.过氧化钙是一种白色结晶体粉末,微溶于水,不溶于醇类、乙醚等,加热至350℃左右开始分解放出氧气,与水缓慢反应生成H2O2.易与酸反应生成H2O2.I、过氧化钙的制取
(1)利用反应Ca+O2$\frac{\underline{\;\;△\;\;}}{\;}$CaO2,在纯氧条件下,制取CaO2.
【查阅资料】金属钙化学性质活泼,能与氧气、氮气、氢气二氧化碳、水、酸等反应.
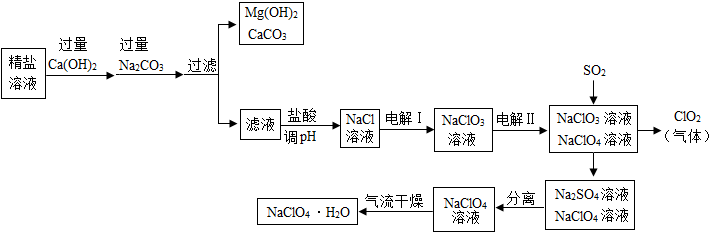
【装置示意图如图1】:请回答下列问题:
①装置A中反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;仪器b的名称为分液漏斗;装置B、D中都盛有浓硫酸,装置B的作用是b(填下面的序号),装置D的作用是c(填下面的序号)
a.观察氧气的流速,判断氧气通入是否过快及氧气与钙反应进行的程度;
b.除去氧气中水,防止水与金属钙反应;
c.防止空气从后面进入C中;
d.检验氧气
②仪器安装后应进行的实验操作:a.通入氧气 b.检查装置气密性 c.加入药品 d.停止通氧气 e.点燃酒精灯 f.熄灭酒精灯 g.冷却至室温,正确的操作顺序为bcaefgd.
③完全反应后,有关数据记录如下:
| 玻璃管质量m0/g | 玻璃管与钙的质量m1/g | 玻璃管与产物的质量m2/g |
| 14.80 | 15.08 | 15.25 |
(2)在实验室可用钙盐制取CaO2?8H2O,再经脱水制得CaO2.流程示意图如图2,
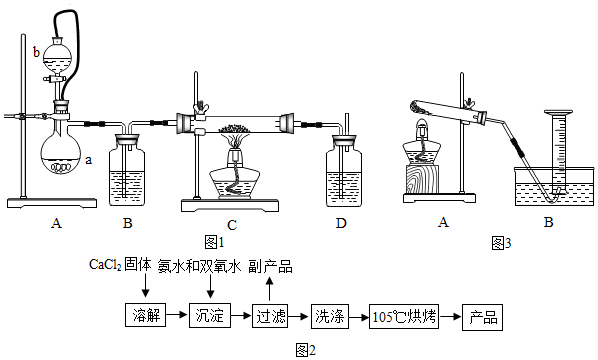
回答下列问题:①用上述方法制取CaO2?8H2O的化学方程式是CaCl2+2NH3•H2O+H2O2+6H2O=CaO2•8H2O+2NH4Cl;
②加入氨水的作用是做反应物.
③沉淀反应时常控制温度在0℃左右,其可能原因是过氧化氢易分解、CaO2?8H2O易分解,控制温度为0℃左右的方法是使用冰水混合物;
④过滤后洗涤沉淀的试剂最好用乙醇 判断沉淀是否完全洗净的试剂为硝酸银溶液;
⑤该制法的副产品为NH4Cl(填化学式),为了提高副产品的产率,结晶前要将溶液的pH调整到合适范围,可加入的试剂是A.
A.盐酸 B.氨水 C.稀硫酸 D.氢氧化钠溶液
II、过氧化钙含量测定
(3)利用图3装置测量产品中CaO2含量,
①指出图中错误之处量筒内没有装满水
②收集氧气的最佳时间是a
a.导管口刚有气泡冒出时 b导管口气泡连续均匀冒出时.
③正确读取量筒内液面的初始、最终读数前都需进行的操作是调整内外液面在一个平面.
④若样品质量为0.20g,反应前量筒读数为2.10mL,反应后量筒读数为24.50mL(常温下氧气的密度为1.429g/L).实验中量筒的最佳规格是A.(填字母序号)
A.50mL B.100mL C.1L
计算样品中CaO2含量.(要求计算过程)
⑤若样品质量用w表示,反应前称量药品和试管总质量为m g,反应后在空气中冷却,称量药品和试管总质量为n g,则CaO2含量=$\frac{9×(m-n)}{4w}$×100%(用含m、n、w的式子表示).
此方案测定结果偏小的原因可能是钙与氧气重新结合.
分析 根据给出的转化关系对应的过程分析每个对应的问题,或者直接分析每个问题,从给出的信息中找对应的信息.
解答 解:
I、①装置A是制取氧气的,利用液体和固体反应,所以应该是过氧化氢在二氧化锰的催化下生成水和氧气,对应的化学方程式为 2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;仪器b的名称为 分液漏斗;由于钙能够和水反应,所以装置B中的硫酸时除去氧气中的水,防止水和钙反应,故选b.而D中都盛有浓硫酸,是防止右侧的空气进入装置C导致钙与空气中的氮气和二氧化碳等反应,故装置D的作用选 c
②仪器安装后应进行的实验操作需要先检查装置的气密性,然后加入药品药品,由于需要排空装置内的空气后才能让氧气和钙反应,所以应该是先通入氧气排空装置内的空气后在点燃酒精灯加热,待反应完全后熄灭酒精灯,此时继续通入氧气知道冷却到室温后停止通知氧气,防止倒入硫酸.故正确的操作顺序为 bcaefgd.
③完全反应后,由有关数据记录,可知,钙的质量为0.28g,理论上生成的过氧化钙的质量为0.5g,则m2应为14.80g+0.5g=15.3g,结果m2与理论值不符,应该是产物中的含有CaO.
(2)
①用上述方法制取CaO2?8H2O,是氯化钙加入了氨水和过氧化氢,生成CaO2?8H2O和氯化铵,对应的化学方程式是 CaCl2+2NH3•H2O+H2O2+6H2O=CaO2•8H2O+2NH4Cl;
②加入氨水的作用是做反应物.
③沉淀反应时常控制温度在0℃左右,其可能原因是过氧化氢易分解、CaO2?8H2O易分解,控制温度为0℃左右的方法是使用冰水混合物;
④由于信息提示“过氧化钙不溶于醇类、乙醚等“,所以过滤后洗涤沉淀的试剂最好用乙醇.判断沉淀是否完全洗净实际上就是看固体表面是否附着氯化铵,也就是检验洗涤后的液体中是否有氯离子,所以所用的试剂为硝酸银溶液;
⑤该制法的副产品为 NH4Cl(填化学式),为了提高副产品的产率,也就是提高氨水的吸收效率,且不能引入新的杂质,所以应该是使用盐酸.故选 A.
II、过氧化钙含量测定
(3)
①指出图中错误之处 量筒内没有装满水
②由于生成气体就是氧气,所以应该是从开始就收集,这一点和氧气的制取里面的收集时区别的,收集氧气强调的是收集氧气的纯净,而本实验强调的收集氧气的多少.所以本实验收集氧气的最佳时间是 a(导管口刚有气泡冒出时).
③正确读取量筒内液面的初始、最终读数前都需进行的操作要保证内外压强相等,避免大气压强的对体积测定的影响,所以要采取的操作是调整内外液面在一个平面.
④若样品质量为0.20g,反应前量筒读数为2.10mL(即0.0021L),反应后量筒读数为24.50mL(即0.0245L)(常温下氧气的密度为1.429g/L).由于体积小于50mL,所以为减少误差,实验中量筒的最佳规格是50mL的量筒.
氧气的质量为1.429g/L×(0.0245L-0.0021L)≈0.032g
设CaO2质量为x
CaO2$\frac{\underline{\;\;△\;\;}}{\;}$Ca+O2↑
72 32
x 0.032g
$\frac{72}{32}$=$\frac{x}{0.032g}$
x=0.072g
样品中CaO2质量分数为$\frac{0.072g}{0.20g}$×100%=36%.
⑤若样品质量用wg表示,反应前称量药品和试管总质量为m g,反应后在空气中冷却,称量药品和试管总质量为n g,根据差量就是生成的氧气的质量可知.生成氧气的质量为mg-ng.
设设CaO2质量为y
CaO2$\frac{\underline{\;\;△\;\;}}{\;}$Ca+O2↑
72 32
y mg-ng
$\frac{72}{32}$=$\frac{y}{mg-ng}$
y=$\frac{9(m-n)}{4}g$
样品中CaO2质量分数为$\frac{\frac{9×(m-n)}{4}g}{wg}$×100%=$\frac{9×(m-n)}{4w}$×100%.
此方案测定结果偏小的原因可能是 钙与氧气重新结合.
故答案为:
(1)
①2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑; 分液漏斗; b; c
②bcaefgd.
③CaO.
(2)
①CaCl2+2NH3•H2O+H2O2+6H2O=CaO2•8H2O+2NH4Cl;
②做反应物.
③过氧化氢易分解、CaO2?8H2O易分解; 使用冰水混合物;
④乙醇;硝酸银溶液;
⑤NH4Cl; A.
(3)
①量筒内没有装满水
②a
③调整内外液面在一个平面.
④A.(填字母序号)
计算样品中CaO2含量.(要求计算过程)
⑤$\frac{9×(m-n)}{4w}$×100%; 钙与氧气重新结合.
点评 读图,从中获得解答题目所需的信息,所以在解答题目时先看解答的问题是什么,然后带着问题去读给出的图进而去寻找解答有用的信息,这样提高了信息扑捉的有效性.解答的问题实际上与复杂的转化图相比,其实很简单很基础,或者可以说转化图提供的是情境,考查基本知识.

| A. | 叶酸的相对分子质量为441 g | |
| B. | 叶酸中氮元素的质量分数大于氧元素的质量分数 | |
| C. | 叶酸中碳、氢、氮、氧四种元素质量比为19:19:7:6 | |
| D. | 叶酸由19个碳原子、19个氢原子、7个氮原子和6个氧原子构成 |
| A. | 长期放置后不会分层的液体一定是溶液 | |
| B. | 配制好6%的NaCl溶液,装瓶时不小心撒漏一部分,瓶中NaCl溶液浓度仍为6% | |
| C. | KNO3饱和溶液一定比KNO3不饱和溶液溶质质量分数大 | |
| D. | 降低饱和溶液的温度,一定有晶体析出 |
| 选项 | 物质 | 除杂试剂(足量) | 操作方法 |
| A | CO(CO2) | 氢氧化钠溶液 | 气体通过盛有氢氧化钠溶液的洗气瓶 |
| B | K2CO3(KCl) | 稀盐酸 | 加入稀盐酸、蒸发、结晶 |
| C | FeSO4(CuSO4) | 锌粉 | 加入锌粉并过滤 |
| D | Zn(Fe) | 稀硫酸 | 加入稀硫酸,过滤 |
| A. | A | B. | B | C. | C | D. | D |
| A.操作顺序 | B.生活化学 |
| ①制取O2停止加热时,先熄灭酒精灯,后撤导管 ②配制溶液需经过计算、称量、溶解等 | ①碳酸氢钠可用于治疗胃酸过多症 ②氢氧化钠可用来改良酸性土壤 |
| C.解释说明 | D.化学鉴别 |
| ①稀有气体作保护气,因为其化学性质稳定 ②一氧化碳用于冶炼金属,因为其具有还原性 | ①看颜色鉴别羊毛纤维和棉纤维 ②带火星的小木条鉴别O2和CO2 |
| A. | A | B. | B | C. | C | D. | D |