题目内容
10.为了验证铝、银、铬三种金属的活动性,已知化学反应:①2Al+3CrSO4=Al2(SO4)3+3Cr ②Cr+2AgNO3=Cr(NO3)2+2Ag ③Ag和H2SO4不反应
(1)根据上述反应,得出这三种金属的活动性由强到弱的顺序是Al>Cr>Ag,写出铬与硫酸反应的化学方程式Cr+H2SO4═CrSO4+H2↑.
(2)用三种药品也能得出三种金属的活动性顺序,这三种药品可能是Al、Ag、CrSO4或Cr、Al2(SO4)3、AgNO3.
(3)上述实验得出比较金属活动性强弱的方法有:①通过金属与酸反应的比较.②通过金属与盐溶液反应的比较.
分析 根据金属活动性顺序,验证金属的活动性顺序是否合理,可根据“反应则活泼,不反应则不活泼”进行分析判断,通过分析方案所能得到的结论,确定是否能得出铝、银、铬三种金属的活动性顺序.要验证三种金属活动性大小关系时,通常采取“三取中”的方法即:取中间金属单质与两端的金属的盐溶液反应或取中间金属的盐溶液与两端金属的单质反应.
解答 解:(1)①2Al+3CrSO4=Al2(SO4)3+3Cr 说明金属活动性铝>铬; ②Cr+2AgNO3=Cr(NO3)2+2Ag说明金属活动性铬>银;③Ag和H2SO4不反应,说明金属活动性银位于氢后;可得三种金属的活动性由强到弱的顺序是Al>Cr>Ag;铬与硫酸反应生成硫酸铬和氢气,化学方程式为:Cr+H2SO4═CrSO4+H2↑;
(2)三组同学认为改用三种药品也可验证出铝、铬、银的活动性顺序,可以利用“三取中”的方法,选用的药品是:铝、硫酸铬、银或硫酸铝、铬、硝酸银.
(3)上述实验得出可以通过金属与酸反应或金属与盐溶液反应比较金属活动性强弱.
故答案为:(1)Al>Cr>Ag; Cr+H2SO4═CrSO4+H2↑;
(2)Al、Ag、CrSO4或Cr、Al2(SO4)3、AgNO3;
(3)①通过金属与酸反应的比较;②通过金属与盐溶液反应的比较.
点评 本题难度不大,考查金属活动性应用,掌握金属活动性应用“反应则活泼、不反应则不活泼”是正确解答此类题的关键.

练习册系列答案
相关题目
3.下列有关实验现象的描述中,正确的是( )
| A. | 加热试管内的碱式碳酸铜,绿色粉末逐渐变黑,试管口有小水滴 | |
| B. | 细铁丝在氧气中燃烧,火星四射,生成红棕色固体 | |
| C. | 镁条在空气中燃烧,产生黑烟,生成黑色粉末 | |
| D. | 向少量氧化铜中加入稀硫酸,有气泡产生,黑色粉末逐渐消失,溶液变蓝 |
1.“土豆农膜”是一种新型环保农膜,通过在塑料中添加土豆淀粉制成.“土豆农膜”可被细菌和微生物释放的酶分解.下列有关说法正确的是( )
| A. | 土豆农膜比普通塑料农膜容易降解 | B. | 淀粉属于高分子化合物 | ||
| C. | 丢弃该农膜会造成“白色污染” | D. | 塑料属于天然高分子材料 |
18.利用饱和碳酸钠溶液与酸反应,小科同学只做了如图甲所示的简易酸碱灭火器装置,并进行操作.操作结束后,对瓶中残留液进行如图乙所示的实验.实验现象:A试管溶液变红色,B试管中有白色沉淀生成.则残留液中含有的溶质有( )


| A. | 盐酸 | B. | 碳酸钠 | C. | 硫酸钠 | D. | 氯化钠 |
5.过氧化钙(CaO2)是一种重要化工试剂,可用于改善水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等.过氧化钙是一种白色结晶体粉末,微溶于水,不溶于醇类、乙醚等,加热至350℃左右开始分解放出氧气,与水缓慢反应生成H2O2.易与酸反应生成H2O2.
I、过氧化钙的制取
(1)利用反应Ca+O2$\frac{\underline{\;\;△\;\;}}{\;}$CaO2,在纯氧条件下,制取CaO2.
【查阅资料】金属钙化学性质活泼,能与氧气、氮气、氢气二氧化碳、水、酸等反应.
【装置示意图如图1】:请回答下列问题:
①装置A中反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;仪器b的名称为分液漏斗;装置B、D中都盛有浓硫酸,装置B的作用是b(填下面的序号),装置D的作用是c(填下面的序号)
a.观察氧气的流速,判断氧气通入是否过快及氧气与钙反应进行的程度;
b.除去氧气中水,防止水与金属钙反应;
c.防止空气从后面进入C中;
d.检验氧气
②仪器安装后应进行的实验操作:a.通入氧气 b.检查装置气密性 c.加入药品 d.停止通氧气 e.点燃酒精灯 f.熄灭酒精灯 g.冷却至室温,正确的操作顺序为bcaefgd.
③完全反应后,有关数据记录如下:
据此可判断m2与理论值不符,则产物中的杂质可能是CaO.
(2)在实验室可用钙盐制取CaO2?8H2O,再经脱水制得CaO2.流程示意图如图2,
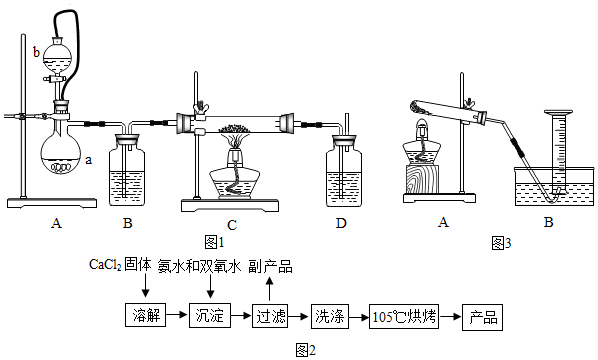
回答下列问题:①用上述方法制取CaO2?8H2O的化学方程式是CaCl2+2NH3•H2O+H2O2+6H2O=CaO2•8H2O+2NH4Cl;
②加入氨水的作用是做反应物.
③沉淀反应时常控制温度在0℃左右,其可能原因是过氧化氢易分解、CaO2?8H2O易分解,控制温度为0℃左右的方法是使用冰水混合物;
④过滤后洗涤沉淀的试剂最好用乙醇 判断沉淀是否完全洗净的试剂为硝酸银溶液;
⑤该制法的副产品为NH4Cl(填化学式),为了提高副产品的产率,结晶前要将溶液的pH调整到合适范围,可加入的试剂是A.
A.盐酸 B.氨水 C.稀硫酸 D.氢氧化钠溶液
II、过氧化钙含量测定
(3)利用图3装置测量产品中CaO2含量,
①指出图中错误之处量筒内没有装满水
②收集氧气的最佳时间是a
a.导管口刚有气泡冒出时 b导管口气泡连续均匀冒出时.
③正确读取量筒内液面的初始、最终读数前都需进行的操作是调整内外液面在一个平面.
④若样品质量为0.20g,反应前量筒读数为2.10mL,反应后量筒读数为24.50mL(常温下氧气的密度为1.429g/L).实验中量筒的最佳规格是A.(填字母序号)
A.50mL B.100mL C.1L
计算样品中CaO2含量.(要求计算过程)
⑤若样品质量用w表示,反应前称量药品和试管总质量为m g,反应后在空气中冷却,称量药品和试管总质量为n g,则CaO2含量=$\frac{9×(m-n)}{4w}$×100%(用含m、n、w的式子表示).
此方案测定结果偏小的原因可能是钙与氧气重新结合.
I、过氧化钙的制取
(1)利用反应Ca+O2$\frac{\underline{\;\;△\;\;}}{\;}$CaO2,在纯氧条件下,制取CaO2.
【查阅资料】金属钙化学性质活泼,能与氧气、氮气、氢气二氧化碳、水、酸等反应.
【装置示意图如图1】:请回答下列问题:
①装置A中反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;仪器b的名称为分液漏斗;装置B、D中都盛有浓硫酸,装置B的作用是b(填下面的序号),装置D的作用是c(填下面的序号)
a.观察氧气的流速,判断氧气通入是否过快及氧气与钙反应进行的程度;
b.除去氧气中水,防止水与金属钙反应;
c.防止空气从后面进入C中;
d.检验氧气
②仪器安装后应进行的实验操作:a.通入氧气 b.检查装置气密性 c.加入药品 d.停止通氧气 e.点燃酒精灯 f.熄灭酒精灯 g.冷却至室温,正确的操作顺序为bcaefgd.
③完全反应后,有关数据记录如下:
| 玻璃管质量m0/g | 玻璃管与钙的质量m1/g | 玻璃管与产物的质量m2/g |
| 14.80 | 15.08 | 15.25 |
(2)在实验室可用钙盐制取CaO2?8H2O,再经脱水制得CaO2.流程示意图如图2,

回答下列问题:①用上述方法制取CaO2?8H2O的化学方程式是CaCl2+2NH3•H2O+H2O2+6H2O=CaO2•8H2O+2NH4Cl;
②加入氨水的作用是做反应物.
③沉淀反应时常控制温度在0℃左右,其可能原因是过氧化氢易分解、CaO2?8H2O易分解,控制温度为0℃左右的方法是使用冰水混合物;
④过滤后洗涤沉淀的试剂最好用乙醇 判断沉淀是否完全洗净的试剂为硝酸银溶液;
⑤该制法的副产品为NH4Cl(填化学式),为了提高副产品的产率,结晶前要将溶液的pH调整到合适范围,可加入的试剂是A.
A.盐酸 B.氨水 C.稀硫酸 D.氢氧化钠溶液
II、过氧化钙含量测定
(3)利用图3装置测量产品中CaO2含量,
①指出图中错误之处量筒内没有装满水
②收集氧气的最佳时间是a
a.导管口刚有气泡冒出时 b导管口气泡连续均匀冒出时.
③正确读取量筒内液面的初始、最终读数前都需进行的操作是调整内外液面在一个平面.
④若样品质量为0.20g,反应前量筒读数为2.10mL,反应后量筒读数为24.50mL(常温下氧气的密度为1.429g/L).实验中量筒的最佳规格是A.(填字母序号)
A.50mL B.100mL C.1L
计算样品中CaO2含量.(要求计算过程)
⑤若样品质量用w表示,反应前称量药品和试管总质量为m g,反应后在空气中冷却,称量药品和试管总质量为n g,则CaO2含量=$\frac{9×(m-n)}{4w}$×100%(用含m、n、w的式子表示).
此方案测定结果偏小的原因可能是钙与氧气重新结合.
15. 焙制糕点所用的发酵粉的主要成分之一是碳酸氢钠.某化学兴趣小组对碳酸氢钠的化学性质进行探究:
焙制糕点所用的发酵粉的主要成分之一是碳酸氢钠.某化学兴趣小组对碳酸氢钠的化学性质进行探究:
【探究实验一】碳酸氢钠溶液的酸碱性:用pH试纸测得碳酸氢钠溶液的pH约为10.由此得出的结论是碳酸氢钠溶液显碱性.
【探究实验二】碳酸氢钠的热稳定性:取一定量的碳酸氢钠放在铜片上加热,如图所示.
【查阅资料】碳酸氢钠受热易分解,生成水、二氧化碳气体和一种常见的固体物质.
(1)加热一段时间后观察烧杯内壁有水珠.
(2)充分加热后,将烧杯迅速倒转过来,加入适量的澄清石灰水,振荡,观察到澄清石灰水变浑浊.
(3)该兴趣小组的同学认为充分加热后的固体产物可能是NaOH或Na2CO3.
①他们猜想的依据是质量守恒定律.
②请设计实验,检验反应后的固体产物是NaOH或Na2CO3,并完成如表.
限选试剂及仪器:稀盐酸、氯化钙溶液、澄清石灰水、酚酞溶液、蒸馏水、试管、胶头滴管.
 焙制糕点所用的发酵粉的主要成分之一是碳酸氢钠.某化学兴趣小组对碳酸氢钠的化学性质进行探究:
焙制糕点所用的发酵粉的主要成分之一是碳酸氢钠.某化学兴趣小组对碳酸氢钠的化学性质进行探究:【探究实验一】碳酸氢钠溶液的酸碱性:用pH试纸测得碳酸氢钠溶液的pH约为10.由此得出的结论是碳酸氢钠溶液显碱性.
【探究实验二】碳酸氢钠的热稳定性:取一定量的碳酸氢钠放在铜片上加热,如图所示.
【查阅资料】碳酸氢钠受热易分解,生成水、二氧化碳气体和一种常见的固体物质.
(1)加热一段时间后观察烧杯内壁有水珠.
(2)充分加热后,将烧杯迅速倒转过来,加入适量的澄清石灰水,振荡,观察到澄清石灰水变浑浊.
(3)该兴趣小组的同学认为充分加热后的固体产物可能是NaOH或Na2CO3.
①他们猜想的依据是质量守恒定律.
②请设计实验,检验反应后的固体产物是NaOH或Na2CO3,并完成如表.
限选试剂及仪器:稀盐酸、氯化钙溶液、澄清石灰水、酚酞溶液、蒸馏水、试管、胶头滴管.
| 序号 | 实验操作 | 预期现象 | 结论 |
| Ⅰ | 取少量加热后的固体产物放入试管A中,加入适量蒸馏水,充分振荡溶解,加入足量氯化钙溶液,振荡,静止 | 产生白色沉淀 | 产物含Na2CO3 |
| Ⅱ | 取Ⅰ操作后的上层清液于试管B中,滴加酚酞溶液 | 溶液不变色 | 产物不含NaOH |
2.下列图象与对应叙述相符合的是( )
| A. |  向一定量的锌粒中加入稀硫酸 | |
| B. |  向pH=3的溶液中加水 | |
| C. |  向一定量的二氧化锰中加入过氧化氢溶液 | |
| D. |  向一定量的氯化钙溶液中加入碳酸钾溶液 |
19.下列食物中富含油脂的是( )
| A. | 肥肉 | B. | 牛奶 | C. | 米饭 | D. | 大白菜 |
20. 甲、乙、丙三种物质间只通过一步反应就能实现如箭头所指方向的转化,下列不符合要求的甲、乙、丙依次为( )
甲、乙、丙三种物质间只通过一步反应就能实现如箭头所指方向的转化,下列不符合要求的甲、乙、丙依次为( )
 甲、乙、丙三种物质间只通过一步反应就能实现如箭头所指方向的转化,下列不符合要求的甲、乙、丙依次为( )
甲、乙、丙三种物质间只通过一步反应就能实现如箭头所指方向的转化,下列不符合要求的甲、乙、丙依次为( )| A. | O2、CuO、H2O | B. | Na2CO3、Na2SO4、NaOH | ||
| C. | FeSO4、FeCl2、Fe | D. | CaCO3、CaCl2、CO2 |