题目内容
20.高氯酸钠晶体(NaClO4•H2O)可用于制备高氯酸.粗盐除去泥沙等不溶性杂质后得到“精盐”(只含MgCl2、CaCl2两种杂质),以“精盐”为原料制备高氯酸钠晶体的流程如下:【资料】高氯酸钠在较高温度下容易分解.
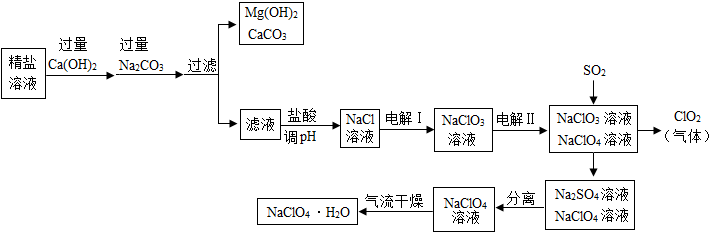
请回答下列问题:
(1)滤液中溶质除NaCl外还含有氢氧化钠和碳酸钠.盐酸调节pH发生的化学反应方程式有NaOH+HCl═NaCl+H2O,Na2CO3+2HCl=2NaCl+H2O+CO2↑.
(2)ClO2中氯元素的化合价是+4.
(3)通入SO2是为了除去NaClO4溶液中少量的NaClO3,该反应的化学方程式为SO2+2NaClO3=2ClO2+Na2SO4.
(4)“气流干燥”时温度应控制在75~95℃之间,其原因是防止温度过高时高氯酸钠分解.
分析 (1)向精盐水中加入过量氢氧化钙时,氢氧化钙和氯化镁反应生成氢氧化镁沉淀和氯化钙,向精盐水中加入过量碳酸钠时,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠;
盐酸调节pH时,稀盐酸和氢氧化钠反应生成氯化钠和水,和碳酸钠反应生成氯化钠、水和二氧化碳;
(2)单质中元素化合价规定为零,化合物中元素化合价代数和为零;
(3)二氧化硫能和氯酸钠反应生成二氧化氯和硫酸钠;
(4)高氯酸钠在较高温度下容易分解,因此“气流干燥”时温度不宜过高.
解答 解:(1)向精盐水中加入过量氢氧化钙时,氢氧化钙和氯化镁反应生成氢氧化镁沉淀和氯化钙,向精盐水中加入过量碳酸钠时,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,因此滤液中溶质除NaCl外还含有氢氧化钠和碳酸钠;
盐酸调节pH时,稀盐酸和氢氧化钠反应生成氯化钠和水,和碳酸钠反应生成氯化钠、水和二氧化碳,反应的化学方程式为:NaOH+HCl═NaCl+H2O,Na2CO3+2HCl=2NaCl+H2O+CO2↑.
故填:氢氧化钠和碳酸钠;NaOH+HCl═NaCl+H2O,Na2CO3+2HCl=2NaCl+H2O+CO2↑.
(2)设ClO2中氯元素的化合价为x,
二氧化氯中氧元素化合价是-2,根据题意有:x+(-2)×2=0,
x=+4,
故填:+4.
(3)通入SO2是为了除去NaClO4溶液中少量的NaClO3,这是因为二氧化硫能和氯酸钠反应生成二氧化氯和硫酸钠,该反应的化学方程式为:SO2+2NaClO3=2ClO2+Na2SO4.
故填:SO2+2NaClO3=2ClO2+Na2SO4.
(4)“气流干燥”时温度应控制在75~95℃之间,其原因是防止温度过高时高氯酸钠分解.
故填:防止温度过高时高氯酸钠分解.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.

 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案| A. | 2个铝离子:2Al3+ | B. | 钠原子的结构示意图: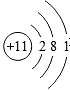 | ||
| C. | 氧分子:O | D. | 氧化镁中镁元素显+2价:$\stackrel{+2}{Mg}$O |
| A. | 整个过程中,硝酸钾溶液的质量分数不断增大 | |
| B. | 整个过程中,硝酸钾的溶解度不断增大 | |
| C. | 整个过程中,始终不断有硝酸钾晶体析出 | |
| D. | 析出晶体后,温度不变,加热相同时间析出的晶体质量相同 |
| A. | 氧化铜和木炭粉 | B. | 食盐和泥沙 | C. | 水和酒精 | D. | 氯化银和硫酸钡 |
I、过氧化钙的制取
(1)利用反应Ca+O2$\frac{\underline{\;\;△\;\;}}{\;}$CaO2,在纯氧条件下,制取CaO2.
【查阅资料】金属钙化学性质活泼,能与氧气、氮气、氢气二氧化碳、水、酸等反应.
【装置示意图如图1】:请回答下列问题:
①装置A中反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;仪器b的名称为分液漏斗;装置B、D中都盛有浓硫酸,装置B的作用是b(填下面的序号),装置D的作用是c(填下面的序号)
a.观察氧气的流速,判断氧气通入是否过快及氧气与钙反应进行的程度;
b.除去氧气中水,防止水与金属钙反应;
c.防止空气从后面进入C中;
d.检验氧气
②仪器安装后应进行的实验操作:a.通入氧气 b.检查装置气密性 c.加入药品 d.停止通氧气 e.点燃酒精灯 f.熄灭酒精灯 g.冷却至室温,正确的操作顺序为bcaefgd.
③完全反应后,有关数据记录如下:
| 玻璃管质量m0/g | 玻璃管与钙的质量m1/g | 玻璃管与产物的质量m2/g |
| 14.80 | 15.08 | 15.25 |
(2)在实验室可用钙盐制取CaO2?8H2O,再经脱水制得CaO2.流程示意图如图2,
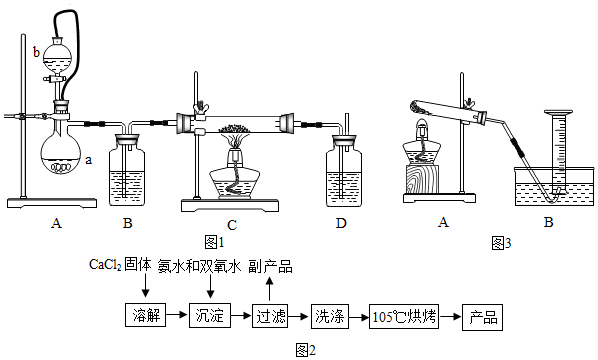
回答下列问题:①用上述方法制取CaO2?8H2O的化学方程式是CaCl2+2NH3•H2O+H2O2+6H2O=CaO2•8H2O+2NH4Cl;
②加入氨水的作用是做反应物.
③沉淀反应时常控制温度在0℃左右,其可能原因是过氧化氢易分解、CaO2?8H2O易分解,控制温度为0℃左右的方法是使用冰水混合物;
④过滤后洗涤沉淀的试剂最好用乙醇 判断沉淀是否完全洗净的试剂为硝酸银溶液;
⑤该制法的副产品为NH4Cl(填化学式),为了提高副产品的产率,结晶前要将溶液的pH调整到合适范围,可加入的试剂是A.
A.盐酸 B.氨水 C.稀硫酸 D.氢氧化钠溶液
II、过氧化钙含量测定
(3)利用图3装置测量产品中CaO2含量,
①指出图中错误之处量筒内没有装满水
②收集氧气的最佳时间是a
a.导管口刚有气泡冒出时 b导管口气泡连续均匀冒出时.
③正确读取量筒内液面的初始、最终读数前都需进行的操作是调整内外液面在一个平面.
④若样品质量为0.20g,反应前量筒读数为2.10mL,反应后量筒读数为24.50mL(常温下氧气的密度为1.429g/L).实验中量筒的最佳规格是A.(填字母序号)
A.50mL B.100mL C.1L
计算样品中CaO2含量.(要求计算过程)
⑤若样品质量用w表示,反应前称量药品和试管总质量为m g,反应后在空气中冷却,称量药品和试管总质量为n g,则CaO2含量=$\frac{9×(m-n)}{4w}$×100%(用含m、n、w的式子表示).
此方案测定结果偏小的原因可能是钙与氧气重新结合.
| A. |  图表示煅烧石灰石 | B. |  图表示CO2在水中的溶解性 | ||
| C. |  图表示向NaOH溶液中加水 | D. |  图表示将浓硫酸加入水中 |
| A. | +2 | B. | +4 | C. | +6 | D. | -2 |
 向K2CO3溶液中滴入Ba(OH)2溶液至恰好完全反应.
向K2CO3溶液中滴入Ba(OH)2溶液至恰好完全反应. K+
K+ CO32-
CO32- OH-
OH-