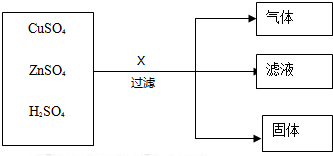
题目内容
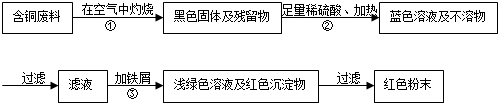
12.某电缆厂在电缆生产过程中,不可避免地会产生一定量的含铜废料(如:零碎电缆).某化学兴趣小组的四位同学得知这一情况后,围绕“从含铜废料中回收铜”提出了各自的看法.甲同学根据已学知识,提出了一套回收方案:
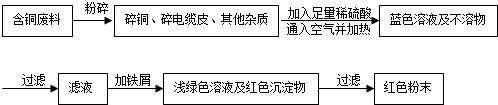
乙同学在查阅资料后得知:在通入空气并加热的条件下,铜可与稀硫酸在溶液中发生反应(方程式为:2Cu+2H2SO4+O2 $\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O),于是他提出了另一套方案:
(1)甲方案的①②③三个步骤中,是铜或铜的化合物有关的化学反应,请写出步骤③发生的化学反应的化学方程式Fe+CuSO4=FeSO4+Cu.
(2)从环保角度对两套方案的不同部分进行比较,你认为乙(填“甲”或“乙”)的方案更合理.理由是:甲方案第一步灼烧会产生污染空气的气体,粉尘,烟雾.
(3)丙认为,无论是甲还是乙的方案,在“加铁屑”这一步时,应该加入略过量的铁屑.你认为丙这么说的道理是:确保CuSO4反应完.丁又提出了疑问:“如果铁过量,剩余的铁会混在红色粉末中,该怎么处理呢?”.请提出你的处理方法:将所得铜粉酸洗后再洗涤、干燥.
(4)最后,老师肯定了同学们的积极思考,但同时指出:方案最后一步所得浅绿色滤液结晶后,会得到一种俗称“绿矾”的工业产品,可增加经济效益.请写出使“绿矾”结晶的可能方法(只写一种):蒸发结晶(“绿矾”溶解度随温度升高而增大).如果直接排放掉滤液,不仅造成了浪费,还会环境污染.
分析 根据铜能与氧气反应生成氧化铜,生成的氧化铜可以与酸反应生成盐和水,在金属活动性顺序中,氢前的金属能与酸反应生成盐和氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,要回收铜可以加入活动性比铜强的金属等知识进行分析.
解答 解:(1)反应③是铁和硫酸铜反应生成硫酸亚铁和铜,化学方程式为:Fe+CuSO4═FeSO4+Cu;
(2)从环保角度对两套方案的不同部分进行比较,甲方案第一步灼烧会产生污染空气的气体,粉尘,烟雾,由此可知乙的方案更合理;
(3)加入略过量的铁屑,是将硫酸铜全部置换出来;如果铁过量,会混在红色粉末中,可以加入适量的酸除去剩余的铁屑;
(4)“绿矾”溶解度随温度升高而增大,所以结晶的方法有:蒸发结晶.
故答案为:(1)①Fe+CuSO4=FeSO4+Cu;
(2)乙,甲方案第一步“灼烧”会产生污染空气的气体、粉尘、烟雾;
(3)确保CuSO4 反应完;将所得铜粉酸洗后再洗涤、干燥;
(4)蒸发结晶.
点评 本题探讨了“从含铜废料中回收铜”的有关问题,设计了不同的方案,并进行评价,考察了考生的思考、探讨、评价等诸多能力.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案
相关题目
3.下列图象中有关量的变化趋势与对应叙述关系正确的是( )
| A. |  分别向质量相等的铁片和锌片中滴加过量的稀硫酸 | |
| B. |  加热一定质量的高锰酸钾 | |
| C. |  某温度下,向一定质量的饱和硝酸钾中不断加入硝酸钾晶体 | |
| D. |  向一定质量的NaOH溶液中滴加水 |
20.邻苯二甲酸二辛酯(化学式为C24H38O4)是一种常见的“塑化剂”.下列说法中正确的是( )
| A. | C24H38O4中碳、氢、氧元素质量比为12:19:2 | |
| B. | 邻苯二甲酸二辛酯中碳元素的质量分数最大 | |
| C. | C24H38O4由24个碳原子、38个氢原子、4个氧原子构成 | |
| D. | 邻苯二甲酸二辛酯属于氧化物 |
17.科学实验要规范操作,下列初中科学实验操作你认为不正确的是( )
| A. |  二氧化碳的验满 | B. |  倾倒液体 | C. |  检验气密性 | D. |  测定溶液PH值 |
4.下列各组离子中,在碱性溶液里能大量共存,且溶液为无色透明的是( )
| A. | K+、MnO4-、Cu2+、SO42- | B. | Na+、CO32-、NO3-、Cl | ||
| C. | K+、Cu2+、SO42-、HCO3- | D. | K+、Na+、Cl-、SO42- |

 如图所示是Ca(OH)2的部分性质实验,回答有关问题.
如图所示是Ca(OH)2的部分性质实验,回答有关问题.