题目内容
7.甲、乙两个实验小组分别进行“Na2CO3和NaCl混合物中Na2CO3含量测定”的实验: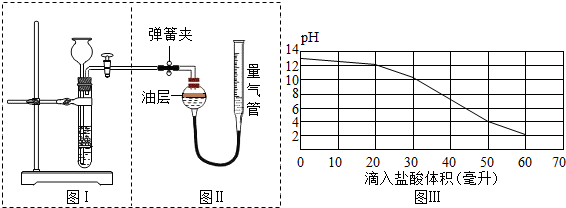
(1)甲组方法:用图Ⅰ、图Ⅱ装置将样品与稀盐酸充分反应,测定反应后生成CO2的体积,经换算并计算出样品中Na2CO3的质量.在图Ⅱ装置中,使反应前后油层上方气体压强和外界大气压相同的操作方法是打开弹簧夹,移动量气管,使油层与量气管的液面处于同一水平面.
(2)乙组方法:取10克样品,加水溶解后逐渐滴加溶质质量分数为3.65%的稀盐酸(稀盐酸的密度
取1.0克/毫升),反应过程中不断搅拌并及时测量滴入盐酸体积与用pH试纸测得的相应溶液的pH绘成如图Ⅲ.请结合图中滴入稀盐酸体积与pH的变化数据,计算样品中Na2CO3质量分数.(碳酸钠与盐酸反应的化学方程式:Na2CO3+2HCl═2NaCl+H2O+CO2↑)
(3)分析甲、乙两组的测定方案,发现乙组对溶液pH的测定误差较大,请说明理由用pH试纸比对颜色有误差.
分析 (1)依据二氧化碳能溶于水但不溶于油解决,当两边无液面差时与外界气压相等.
(2)利用所用稀盐酸的质量,再利用化学方程式可求碳酸钠的质量;
(3)根据用pH试纸比对颜色有误差解答.
解答 解:(1)为保证收集的二氧化碳量的准确,防止二氧化碳溶于水,所以液体采用不溶解二氧化碳的油进行收集.
使反应前后油层上方气体压强和外界大气压相同操作方法是:打开弹簧夹,移动量气管,使油层与量气管的液面处于同一水平面.故填:打开弹簧夹,移动量气管,使油层与量气管的液面处于同一水平面.
(2)稀盐酸质量是:40毫升×1.0克/毫升×3.65%=1.46g,设碳酸钠的质量是x
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73
x 1.46g
$\frac{106}{x}=\frac{73}{1.46g}$
x=2.12g
样品中Na2CO3的含量是$\frac{2.12g}{10g}$×100%=21.2%;
(3)用pH试纸比对颜色有误差.
答案:
(1)打开弹簧夹,移动量气管,使油层与量气管的液面处于同一水平面;
(2)21.2%;
(3)用pH试纸比对颜色有误差
点评 本题主要考查测定混合物中某种成分含量方面的知识,解答本题要从物质的性质方面进行分析、判断,从而得出正确的结论.此题是一道实验综合题,涉及到实验的基本操作和根据化学方程式的计算,是一道训练学生分析问题能力的好题.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
12.下列有关设想或做法,正确的是( )
| A. | 生活污水任意排放 | B. | 用水灭火可以降低可燃物的着火点 | ||
| C. | 禁止使用化肥和农药 | D. | 开发利用太阳能 |
19.下列生活中使用的物品主要成份为天然材料的是( )
| A. |  橡胶鞋底 | B. |  尼龙背包 | ||
| C. |  纯棉T恤 | D. |  塑料滑板 |
16.下面是对某一主题知识的归纳,正确的一组是( )
| A. | 生活常识:除水壶中的水垢--加入食盐水 | |
| B. | 资源保护:防止铁生锈--在铁制品表面涂油 | |
| C. | 安全用气:煤气泄漏--先打开排气扇 | |
| D. | 食品安全:海产品保鲜--用甲醛溶液浸泡 |
17. 李亮同学学了化学反应方程式后便想用微观示意图来表示它,如图所示的是李亮用微观示意图表示两种物质发生反应的情况,其中○和
李亮同学学了化学反应方程式后便想用微观示意图来表示它,如图所示的是李亮用微观示意图表示两种物质发生反应的情况,其中○和 分别代表不同的微粒,下列说法正确的是( )
分别代表不同的微粒,下列说法正确的是( )
 李亮同学学了化学反应方程式后便想用微观示意图来表示它,如图所示的是李亮用微观示意图表示两种物质发生反应的情况,其中○和
李亮同学学了化学反应方程式后便想用微观示意图来表示它,如图所示的是李亮用微观示意图表示两种物质发生反应的情况,其中○和 分别代表不同的微粒,下列说法正确的是( )
分别代表不同的微粒,下列说法正确的是( )| A. | 反应前后分子的数量保持不变 | |
| B. | 该反应属于化合反应 | |
| C. | 反应前后物质的总质量发生了变化 | |
| D. | 该微观示意图可表示为CO与O2的反应 |
 我们学习了O2、CO2、H2这三种气体的性质.某小组同学用图所示装置成功干燥并收集了某纯净气体,甲、乙、丙三位同学对该气体的组成有不同的认识,甲认为可能是O2,乙认为可能是CO2,丙认为可能是H2.你认为他们之中甲推测是正确的,并说明理由因为氧气不与氢氧化钠反应,密度比空气大.
我们学习了O2、CO2、H2这三种气体的性质.某小组同学用图所示装置成功干燥并收集了某纯净气体,甲、乙、丙三位同学对该气体的组成有不同的认识,甲认为可能是O2,乙认为可能是CO2,丙认为可能是H2.你认为他们之中甲推测是正确的,并说明理由因为氧气不与氢氧化钠反应,密度比空气大. 如图所示,电动橡皮擦是用小电动机带动橡皮旋转,具有准确、快速、干净、不易擦破纸的特点,受到学生的喜欢.
如图所示,电动橡皮擦是用小电动机带动橡皮旋转,具有准确、快速、干净、不易擦破纸的特点,受到学生的喜欢.