题目内容
12.某工化肥厂需大量二氧化碳生产化肥,欲购进一批石灰石(其中杂质不参加任何反应),厂家到产地取样分析以确定价格.他们取样2克,并把20克稀盐酸分四次加入,充分反应后,每次剩余固体质量见表| 稀盐酸的用量 | 剩余固体的质量/g |
| 第一次加入5g | 1.4g |
| 第二次再加入5g | 0.8g |
| 第三次再加入5g | 0.4g |
| 第四次再加入5g | 0.4g |
(1)2克石灰石样品中含有杂质的质量是0.4克.
(2)石灰石样品中碳酸钙的质量分数是多少?
(3)1000千克这种石灰石充分煅烧后,可得二氧化碳质量是多少?( CaCO3$\frac{\underline{\;高温\;}}{\;}$ CaO+CO2↑ )
分析 根据加入盐酸至质量不再改变时,此时剩余的为杂质,进而可以求算碳酸钙的质量,也就可以求算出样品中碳酸钙的质量分数,进而结合化学方程式和含杂石灰石的质量求算二氧化碳的质量(不要使用盐酸和碳酸钙反应的方程式,而是碳酸钙高温煅烧的方程式).
解答 解:当加入盐酸至固体不再减少时,此时剩余物质为杂质,其质量为0.4g,则2g样品中碳酸钙的质量分数为$\frac{2g-0.4g}{2g}$×100%=80%
设1000千克石灰石充分煅烧后生成的二氧化碳的质量为x
CaCO3$\frac{\underline{\;高温\;}}{\;}$ CaO+CO2↑
100 44
1000kg×80% x
$\frac{100}{44}$=$\frac{1000kg×80%}{x}$
x=352kg
答:(1)2克石灰石样品中含有杂质的质量是 0.4克.
(2)石灰石样品中碳酸钙的质量分数是80%.
(3)1000千克这种石灰石充分煅烧后,可得二氧化碳质量是352kg.
点评 杂质不可以用于化学方程式的计算,在计算中一定要首先确定数据是纯净物还是混合物.

练习册系列答案
相关题目
3.下列情况①煤的燃烧②工业废气的任意排放③人工呼吸④飞机汽车尾气的排放,可引起大气污染的是( )
| A. | ①②③ | B. | ③④ | C. | ①②③④ | D. | ①②④ |
20.下列物质属于纯净物的是( )
| A. | 可燃冰 | B. | 生铁 | C. | 蒸馏水 | D. | 大理石 |
7.在一只密闭容器内有四种物质,在一定条件下充分反应,测得反应前后各物质的质量如表:
下列说法正确的是( )
| 物质 | X | Y | Z | Q |
| 反应前质量/g | 8 | 2 | 40 | 5 |
| 反应后质量/g | 待测 | 24 | 8 | 23 |
| A. | 该反应一定是分解反应 | B. | Y、Q的相对分子质量比一定为11:9 | ||
| C. | 反应后X的质量为0 | D. | 在反应中X和Z的质量比为1:5 |
17.下列基本实验操作中,正确的是( )
| A. |  | B. |  | C. |  | D. |  |
2.现有10克氢气和氧气的混合气体,点燃后生成了9克水.则原混合气体中氢气和氧气的质量比可能是( )
| A. | 1:8 | B. | 1:9 | C. | 1:1 | D. | 1:4 |
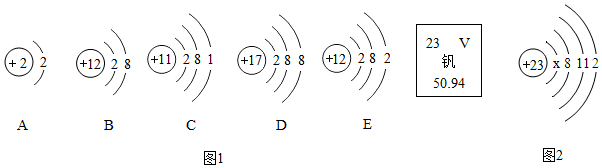
 (1)N(NO2)3 是科学家2011年发现的一种新型火箭燃料,其中氮元素和氧元素的质量比为7:12.
(1)N(NO2)3 是科学家2011年发现的一种新型火箭燃料,其中氮元素和氧元素的质量比为7:12.