题目内容
20.下列说法或做法正确的是( )| A. | 室内起火,立即打开窗户呼救 | |
| B. | 家里的天然气泄漏,立即打开排油烟机 | |
| C. | 酸溶液沾到皮肤上,立即涂碱溶液中和 | |
| D. | 道尔顿提出了近代原子学说 |
分析 A、室内起火时打开门窗,会造成空气流通.
B、根据可燃性气体与空气混合后点燃可能发生爆炸,进行分析判断.
C、根据酸溶液沾到皮肤上的处理方法进行分析判断.
D、根据道尔顿的贡献进行分析.
解答 解:A、室内起火时,不能立即打开门窗呼救,否则空气流通,火势更旺,故选项做法错误.
B、可燃性气体与空气混合后点燃可能发生爆炸,天然气具有可燃性,打开油烟机会产生电火花,可能发生爆炸,故选项说法错误.
C、酸溶液沾到皮肤上,先用大量的水冲洗,不能立即涂碱溶液中和,因为碱溶液也具有很强的腐蚀性,故选项做法错误.
D、道尔顿提出了近代原子学说,故选项做法正确.
故选D.
点评 化学与我们的生活息息相关,了解事故发生的原理,学会预防和防护的措施,对于保障生命、财产的安全及正确解答本题有着重要意义.

练习册系列答案
相关题目
11.下列对消化系统的相关知识叙述不正确的是( )
| A. | 蛋白质在胃液作用下进行初步的消化,进入小肠后被消化液充分分解成氨基酸 | |
| B. | 淀粉在唾液淀粉酶作用下分解成葡萄糖,在小肠处被吸收 | |
| C. | 胆汁虽不含消化酶,但能促进脂肪的消化 | |
| D. | 水、无机盐、维生素不经过消化,在消化道内可以直接被吸收 |
8.软锰矿的主要成分是MnO2,还含有少量重金属化合物等杂质.黄铁矿的 主要成分是FeS2,还含有硅、铝的氧化物等杂质.工业上采用同槽酸浸工艺制备碳酸锰并回收硫酸铵,其主要流程如下:
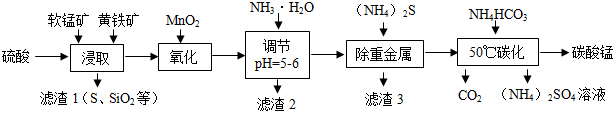
资料:Ⅰ.“氧化”时发生反应:MnO2+2FeSO4+2H2SO4=Fe2(SO4)3+MnSO4+2H2O
Ⅱ.部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH见表:
请回答:
(1)为了提高锰元素的浸出率,在“浸取”时可采取的措施有:①适当升高温度;②搅拌;③加入足量硫酸;
(2)“滤渣2”中主要成分的化学式为Al(OH)3、Fe(OH)3;
(3)“除重金属”时使用(NH4)2S而不使用Na2S的原因是能够防止带入钠离子;
(4)“50℃碳化”得到碳酸锰,反应的化学方程式为MnSO4+2NH4HCO3=MnCO3+(NH4)2SO4+H2O+CO2↑;
(5 )生成的碳酸锰产品需经充分洗涤,检验产品完全洗净的方法是取最后一次洗涤液,加入氯化钡溶液,不产生沉淀.

资料:Ⅰ.“氧化”时发生反应:MnO2+2FeSO4+2H2SO4=Fe2(SO4)3+MnSO4+2H2O
Ⅱ.部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH见表:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 10.4 |
(1)为了提高锰元素的浸出率,在“浸取”时可采取的措施有:①适当升高温度;②搅拌;③加入足量硫酸;
(2)“滤渣2”中主要成分的化学式为Al(OH)3、Fe(OH)3;
(3)“除重金属”时使用(NH4)2S而不使用Na2S的原因是能够防止带入钠离子;
(4)“50℃碳化”得到碳酸锰,反应的化学方程式为MnSO4+2NH4HCO3=MnCO3+(NH4)2SO4+H2O+CO2↑;
(5 )生成的碳酸锰产品需经充分洗涤,检验产品完全洗净的方法是取最后一次洗涤液,加入氯化钡溶液,不产生沉淀.
 我们每天摄入的食物不仅要保证一定的数量,还要注意合理搭配,以保证各种营养素的均衡摄入.“营养平衡膳食宝塔”为我们提供了合理选择食物的指南.请回答问题:
我们每天摄入的食物不仅要保证一定的数量,还要注意合理搭配,以保证各种营养素的均衡摄入.“营养平衡膳食宝塔”为我们提供了合理选择食物的指南.请回答问题: