题目内容
8.软锰矿的主要成分是MnO2,还含有少量重金属化合物等杂质.黄铁矿的 主要成分是FeS2,还含有硅、铝的氧化物等杂质.工业上采用同槽酸浸工艺制备碳酸锰并回收硫酸铵,其主要流程如下: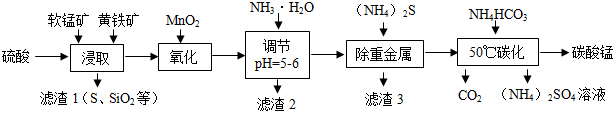
资料:Ⅰ.“氧化”时发生反应:MnO2+2FeSO4+2H2SO4=Fe2(SO4)3+MnSO4+2H2O
Ⅱ.部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH见表:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 10.4 |
(1)为了提高锰元素的浸出率,在“浸取”时可采取的措施有:①适当升高温度;②搅拌;③加入足量硫酸;
(2)“滤渣2”中主要成分的化学式为Al(OH)3、Fe(OH)3;
(3)“除重金属”时使用(NH4)2S而不使用Na2S的原因是能够防止带入钠离子;
(4)“50℃碳化”得到碳酸锰,反应的化学方程式为MnSO4+2NH4HCO3=MnCO3+(NH4)2SO4+H2O+CO2↑;
(5 )生成的碳酸锰产品需经充分洗涤,检验产品完全洗净的方法是取最后一次洗涤液,加入氯化钡溶液,不产生沉淀.
分析 (1)为了提高锰元素的浸出率,在“浸取”时可采取的措施有:①适当升高温度;②搅拌;③加入足量硫酸;
(2)pH在5~6时,铝离子、铁离子已经完全沉淀;
(3)“除重金属”时使用(NH4)2S而不使用Na2S的原因是为了防止带入钠离子;
(4)硫酸锰和碳酸氢铵反应生成碳酸锰、硫酸铵、水和二氧化碳;
(5 )钡离子和硫酸根离子能够结合生成白色沉淀硫酸钡.
解答 解:(1)为了提高锰元素的浸出率,在“浸取”时可采取的措施有:①适当升高温度;②搅拌;③加入足量硫酸.
故填:加入足量硫酸.
(2)pH在5~6时,铝离子、铁离子已经完全沉淀,因此“滤渣2”中主要成分的化学式为Al(OH)3、Fe(OH)3.
故填:Al(OH)3、Fe(OH)3.
(3)“除重金属”时使用(NH4)2S而不使用Na2S的原因是能够防止带入钠离子.
故填:能够防止带入钠离子.
(4)“50℃碳化”得到碳酸锰,过程中硫酸锰和碳酸氢铵反应生成碳酸锰、硫酸铵、水和二氧化碳,反应的化学方程式为:MnSO4+2NH4HCO3=MnCO3+(NH4)2SO4+H2O+CO2↑.
故填:MnSO4+2NH4HCO3=MnCO3+(NH4)2SO4+H2O+CO2↑.
(5 )生成的碳酸锰产品需经充分洗涤,检验产品完全洗净的方法是:取最后一次洗涤液,加入氯化钡溶液,不产生沉淀,说明已经洗的干净.
故填:取最后一次洗涤液,加入氯化钡溶液,不产生沉淀.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.

练习册系列答案
相关题目
18.央视二套《这是真的吗)栏目播出了电脑浸在液体中也能正常工作的新鲜事,原来这种无色液体是被称作“绝缘液”的液态一氟二氯乙烷,这种液体可为手机电脑“洗澡“,用来清洗电子产品,一氟二氯乙烷的化学式为(CCl2FCH3),下列对一氟二氯乙烷的认识正确的是( )
| A. | 一氟二氯乙烷是氧化物 | |
| B. | 一氟二氯乙烷的相对分子质量为117克 | |
| C. | 一氟二氯乙烷中氟元素的质量分数最小 | |
| D. | 一氟二氯乙烷中碳元素与氢元素的质量比为8:1 |
19.实验室里用书本上装置还原氧化铁的过程中,可能生成四氧化三铁、氧化亚铁或铁等固体物质.关于该实验,下列说法错误的是( )
| A. | 实验时,试管中澄清的石灰水变浑浊,证明该反应有二氧化碳生成 | |
| B. | 实验结束时,玻璃管中红色的氧化铁粉末变成黑色,该产物不一定是铁 | |
| C. | 反应后,玻璃管中的固体物质的质量比反应前减少了,证明一定有铁生成 | |
| D. | 为了减少空气污染处理尾气,可以将尾气在硬质玻璃管下方点燃 |
16.为了测定某陨石中铁的含量,某化学兴趣小组的同学进行了以下实验:取四份相同质量的样品分别放入等质量的烧杯中,然后分别加入稀硫酸,充分反应后用天平称量,(杂质不与稀硫酸反应产生气体)几次试验数据如下,请回答下列问题并计算:
(1)在第1次实验结束后,反应物硫酸完全反应完了.
(2)50.0g样品与足量稀硫酸反应最多能生成气体0.5g.
(3)计算陨石中铁的质量分数(写出具体计算过程).
| 试验次序 | 第1次 | 第2次 | 第3次 | 第4次 |
| 所取样品的质量/g | 50.0 | 50.0 | 50.0 | 50.0 |
| 加入稀硫酸的质量/g | 20.0 | 40.0 | 60.0 | 80.0 |
| 生成气体的质量/g | 0.2 | 0.4 | 0.5 | 0.5 |
(2)50.0g样品与足量稀硫酸反应最多能生成气体0.5g.
(3)计算陨石中铁的质量分数(写出具体计算过程).
13.下列不包含化学变化的是( )
| A. |  铁生锈 | B. |  二氧化碳性质探究 | ||
| C. |  洗涤剂洗碗 | D. |  分子性质探究 |
20.下列说法或做法正确的是( )
| A. | 室内起火,立即打开窗户呼救 | |
| B. | 家里的天然气泄漏,立即打开排油烟机 | |
| C. | 酸溶液沾到皮肤上,立即涂碱溶液中和 | |
| D. | 道尔顿提出了近代原子学说 |
17.下列肥料属于复合肥料的是( )
| A. | KNO3 | B. | NH4HCO3 | C. | (NH4)2SO4 | D. | Ca3(PO4)2 |
13.2016年6月5日为世界环境日,倡导人们“可持续消费和生产”,下列做法不符合这一思想的是( )
| A. | 节约资源,节能减排 | B. | 重复利用,循环再生 | ||
| C. | 低碳环保,绿色出行 | D. | 铺张浪费,相互攀比 |