题目内容
12.叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某化学小组同学对其进行下列研究.【查阅资料】
①NaN3受撞击会生成Na、N2.
②NaN3遇盐酸、H2SO4溶液没有气体生成.
③碱石灰是CaO和 NaOH的混合物.
④NaN3的制备方法是:将金属钠与液态氨反应制得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和NH3.
【问题探究】
(1)汽车经撞击后,30毫秒内引发NaN3迅速分解,写出该反应的化学方程式2NaN3$\frac{\underline{\;撞击\;}}{\;}$2Na+3N2↑.
(2)工业级NaN3中常含有少量的Na2CO3,其原因是2NaOH+CO2═Na2CO3+H2O(用化学方程式表示).
(3)为测定某工业级NaN3样品中含有Na2CO3的质量分数,小组同学设计了如图实验装置.
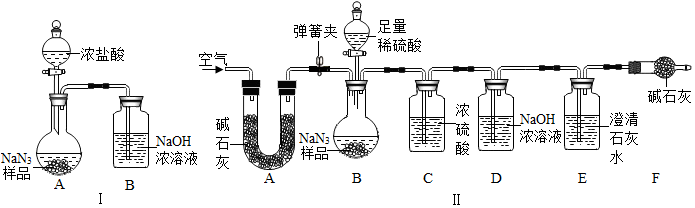
①小明同学认为通过测定装置Ⅰ中反应前后B的质量差,再通过相应计算,就可测定Na2CO3的纯度,小组同学通过讨论装置Ⅰ认为很多因素会导致测定数据不准确,误差太大.小明同学在大家讨论的基础上,又设计了装置Ⅱ.
请分析:装置Ⅱ中A的作用是除去空气中的二氧化碳;若无装置C,对测定结果造成的影响是偏大(填“偏大”、“偏小”或“无影响”);装置E的作用是检验二氧化碳是否被D装置完全吸收,防止空气中的二氧化碳进入D装置中.
②根据装置Ⅱ,小组同学设计的实验步骤有:
a.称量装置D. b.称量样品,检查装置气密性.
c.打开弹簧夹,鼓入空气.
d.关闭弹簧夹,打开分液漏斗的活塞和玻璃塞,注入足量的稀硫酸,关闭活塞和玻璃塞.
为保证测定结果精确,正确的操作顺序为bcadca(填字母序号,可重复).
③计算碳酸钠的质量分数时,至少需要测定3个数据.(填数字)
分析 (1)根据反应物、生成物、反应条件及其质量守恒定律可以书写反应的化学方程式;
(2)工业级NaN3中常含有少量的碳酸钠,是因为氢氧化钠和空气中的二氧化碳反应生成碳酸钠和水;
(3)碱石灰能够吸收水蒸气和二氧化碳;
二氧化碳能使澄清石灰水变浑浊;
计算碳酸钠的质量分数时,需要测定样品质量,反应前D装置的质量,反应后D装置的质量.
解答 解:(1)汽车经撞击后,NaN3迅速分解生成钠和氮气,该反应的化学方程式为:2NaN3$\frac{\underline{\;撞击\;}}{\;}$2Na+3N2↑.
故填:2NaN3$\frac{\underline{\;撞击\;}}{\;}$2Na+3N2↑.
(2)工业级NaN3中常含有少量的Na2CO3,其原因是氢氧化钠和空气中的二氧化碳反应生成了碳酸钠和水,反应的化学方程式为:2NaOH+CO2═Na2CO3+H2O.
故填:2NaOH+CO2═Na2CO3+H2O.
(3)①装置Ⅱ中A的作用是除去空气中的二氧化碳;
若无装置C,水蒸气会进入D装置中,导致测定的二氧化碳质量偏大,从而导致测定结果偏大;
装置E的作用是检验二氧化碳是否被D装置完全吸收,防止空气中的二氧化碳进入D装置中.
故填:除去空气中的二氧化碳;偏大;检验二氧化碳是否被D装置完全吸收,防止空气中的二氧化碳进入D装置中.
②为保证测定结果精确,正确的操作顺序为:称量样品,检查装置气密性,打开弹簧夹,鼓入空气,称量装置D,关闭弹簧夹,打开分液漏斗的活塞和玻璃塞,注入足量的稀硫酸,关闭活塞和玻璃塞,打开弹簧夹,鼓入空气,称量装置D.
故填:bcadca.
③计算碳酸钠的质量分数时,至少需要测定样品质量,反应前D装置的质量,反应后D装置的质量等3个数据.
故填:3.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.


| A. | “X”元素的核电荷数是9 | |
| B. | “X”元素在化学变化中容易形成阳离子 | |
| C. | “X”元素属于非金属元素 | |
| D. | 由氧、X、氖所形成的单质中,等质量三种单质所含原子个数最多的是氧原子 |
| A. | 室内起火,立即打开窗户呼救 | |
| B. | 家里的天然气泄漏,立即打开排油烟机 | |
| C. | 酸溶液沾到皮肤上,立即涂碱溶液中和 | |
| D. | 道尔顿提出了近代原子学说 |
| A. | KNO3 | B. | NH4HCO3 | C. | (NH4)2SO4 | D. | Ca3(PO4)2 |
| 冷水浸泡 | 加热煎制 | 箅渣取液 | 灌装保存 |
 |  |  |  |
| A | B | C | D |
| A. | 硫酸铜晶体,胆矾,CuSO4•5H2O | B. | 氯化钠,苏打,NaCl | ||
| C. | 氢氧化钠,纯碱,NaOH | D. | 碳酸钙,生石灰,Ca(OH)2 |
