题目内容
3.小亮在实验室发现一瓶盛有无色溶液的试剂瓶,其标签破损,从残余部分只能看出溶质质量分数为10%,具体是什么物质无法辨认.老师告诉他,这瓶溶液可能是氢氧化钠、氯化钠、氢氧化钙或是碳酸钠中的一种.(1)小亮查阅氢氧化钙常温下的溶解度为0.18g后,认为该溶液不可能是氢氧化钙,理由是Ca(OH)2微溶于水,常温下不可能得到10%的氢氧化钙溶液
.
(2)小亮取少量样品于试管中,滴加无色酚酞溶液,试液变红色,该溶液不可能是NaCl溶液.
(3)为进一步确定该溶液的成分,小亮继续进行了下列实验,请你一起参与,并填写实验报告.
| 实验方案 | 实验步骤 | 实验现象 | 实验结论 |
| 甲 | 取少量溶液于试管中,滴加稀盐酸 | 有气泡产生 | 该溶液是碳酸钠溶液 |
| 乙 | 取少量溶液于试管中,滴加氯化钙溶液 | 有白色沉淀产生 |
(4)小亮实验后还进行了反思:
①小亮认为方案乙中的氯化钙还可以用一种碱来替代,那么它是Ca(OH)2溶液(填化学式).
②小亮认为虽然经过实验确认该无色溶液为碳酸钠溶液,可是该溶液还可能是氢氧化钠溶液放置于空气中变质而生成的,你认为他的猜想是是合理(填“是”或“否”).
分析 (1)根据氢氧化钙的溶解度及溶质质量分数的关系分析;
(2)根据溶液的酸碱性进行分析;
(3)根据碳酸钠和酸反应产生气泡,和氯化钙等钙离子结合产生沉淀进行分析;
(4)根据碳酸钠的性质及氢氧化钠与二氧化碳反应的性质分析.
解答 解:(1)常温下氢氧化钙的溶解度为0.18g,其饱和溶液中溶质质量分数=$\frac{0.18g}{100g+0.18g}$×100%<0.18%,而该溶液溶质质量分数为10%,所以不可能是氢氧化钙;
(2)从题中分析,能使试液变红色,指示剂为无色酚酞,而氯化钠是盐,显中性,不能使无色酚酞试液变红色,可以排除氯化钠;
(3)氯化钙和稀盐酸都可以用来鉴别氢氧化钠和碳酸钠,氯化钙与碳酸钠反应产生碳酸钙白色沉淀,方程式为CaCl2+Na2CO3═CaCO3↓+2NaCl,稀盐酸与碳酸钠反应产生二氧化碳气体,方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑;
(4)①鉴别氢氧化钠和碳酸钠还可用澄清石灰水,能产生碳酸钙沉淀,方程式为Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;
②由于氢氧化钠能与二氧化碳反应产生碳酸钠,因此钙溶液可能是氢氧化钠溶液放置于空气中变质而生成的;
故答案为:(1)Ca(OH)2微溶于水,常温下不可能得到10%的氢氧化钙溶液;
(2)NaCl溶液;
(3)实验现象:有气泡产生;有白色沉淀产生;CaCl2+Na2CO3=CaCO3↓+2NaCl;
(4)①Ca(OH)2;②是.
点评 本题根据氢氧化钠、氯化钠、氢氧化钙、碳酸钠几种物质的性质特点,采取“利用测定结果进行先排除,最后进行实验检验的”方法确定未知溶液,涉及对四种物质相关性质及变化规律的考查.

练习册系列答案
 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
12. MgSO4、KCl广泛用于工业领域,参考如图判断下列说法正确的是( )
MgSO4、KCl广泛用于工业领域,参考如图判断下列说法正确的是( )
 MgSO4、KCl广泛用于工业领域,参考如图判断下列说法正确的是( )
MgSO4、KCl广泛用于工业领域,参考如图判断下列说法正确的是( )| A. | t2℃时MgSO4的饱和溶液降温才有溶质析出 | |
| B. | t3℃时的KCl溶液降温至0℃一定有溶质析出 | |
| C. | t1℃两物质的饱和溶液升温到t2℃,溶质质量分数相等 | |
| D. | t1℃MgSO4的饱和溶液恒温蒸发溶剂不一定有溶质析出 |
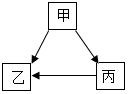 甲、乙、丙三种物质经一步反应的转化关系如图所示,其中部分反应物、生成物及反应条件已略去.
甲、乙、丙三种物质经一步反应的转化关系如图所示,其中部分反应物、生成物及反应条件已略去.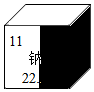 受损元素周期表中某元素的残留信息如图所示,根据残留信息得出的下列说法中正确的是
受损元素周期表中某元素的残留信息如图所示,根据残留信息得出的下列说法中正确的是 A-J是初中化学常见的物质,它们之间有如图所示的转化关系,部分反应条件已略去,已知反应②是化合反应,反应④是分解反应,E、F、G、H中滴加酚酞溶液都显红色,C和J均由相同的两种元素组成.
A-J是初中化学常见的物质,它们之间有如图所示的转化关系,部分反应条件已略去,已知反应②是化合反应,反应④是分解反应,E、F、G、H中滴加酚酞溶液都显红色,C和J均由相同的两种元素组成.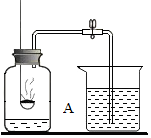 用如图所示的装置测定空气里氧气的含量,实验时先在集气瓶里加入少量水,做上记号.用弹簧夹夹紧乳胶管.点燃燃烧匙内的红磷后,立即深入瓶中并把塞子塞紧,待红磷熄灭后,发现红磷还有剩余,冷却,打开弹簧夹,烧杯中的水倒流进集气瓶中,液面上升到图中A位置.
用如图所示的装置测定空气里氧气的含量,实验时先在集气瓶里加入少量水,做上记号.用弹簧夹夹紧乳胶管.点燃燃烧匙内的红磷后,立即深入瓶中并把塞子塞紧,待红磷熄灭后,发现红磷还有剩余,冷却,打开弹簧夹,烧杯中的水倒流进集气瓶中,液面上升到图中A位置.