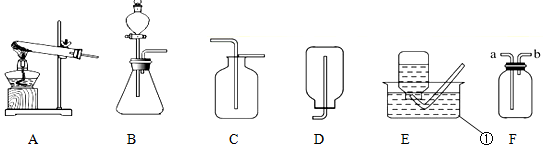
题目内容
20.有些晶体按比例带有一定量的结晶水,带有结晶水的晶体在一定温度下会脱去结晶水.草酸晶体(H2C2O4•xH2O)在常温下是一种无色透明晶体.草酸晶体受热时分解的化学方程式为:H2C2O4•xH2O $\frac{\underline{\;\;△\;\;}}{\;}$(x+1)H2O+CO2↑+CO↑
某化学兴趣小组的同学利用该信息以及所学的知识设计并开展实验,测定草酸晶体中结晶水的个数即x的数据.已知碱石灰是氧化钙固体和氢氧化钠固体的混合物,可以吸收水蒸气和二氧化碳(图中固定装置已略去,装置气密性良好,装置A、B中的试剂足量).

Ⅰ.测量装置A、B的质量,连接装置;
Ⅱ.取质量为m的草酸晶体,加热至完全分解,将产物全部通入以上装置;Ⅲ.测量并
记录装置A增加的质量为a,装置B增加的质量为b;Ⅳ.甲乙两位同学分别利用装置A、
B所得数据计算该草酸晶体中结晶水的个数即x的数据.
请回答下列问题:
(1)装置A中盛放的液体是浓硫酸;装置B的作用是吸收二氧化碳;该装置还存在的不足之处没有处理尾气.
(2)乙同学对利用装置B测量结果计算的可靠性进行反思与评价,认为反应后装置A中残留的气体会使自己的计算结果偏大(填“偏小”或“偏大”).
(3)甲同学依据装置A测量结果计算x为$\frac{5a-m}{m-a}$(用字母表示).
(4)若甲同学将装置A、B交换位置,可以通过装置D的质量变化来准确测定草酸晶体中结晶水的个数.
分析 (1)浓硫酸具有吸水性,可以干燥某些气体;
碱石灰能够吸收二氧化碳气体;
一氧化碳有毒,扩散到空气中会污染环境;
(2)根据反应的化学方程式及其提供的数据可以进行相关方面的计算和判断;
(3)甲同学依据装置A测量结果、反应的化学方程式及其提供的数据可以进行相关方面的计算和判断;
(4)若甲同学将装置A、B交换位置,可以通过装置D的质量变化来准确测定草酸晶体中结晶水的个数.
解答 解:(1)装置A中盛放的液体是浓硫酸,用来吸收反应生成的水蒸气;
装置B的作用是吸收二氧化碳;
该装置还存在的不足之处没有处理尾气.
故填:浓硫酸;吸收二氧化碳;没有处理尾气.
(2)反应后装置A中残留的二氧化碳会导致b的值偏小,从而导致计算结果偏大.
故填:偏大.
(3)根据题意有:H2C2O4•xH2O $\frac{\underline{\;\;△\;\;}}{\;}$(x+1)H2O+CO2↑+CO↑,
90+18x 18(x+1)
m a
$\frac{90+18x}{m}$=$\frac{18(x+1)}{a}$,
x=$\frac{5a-m}{m-a}$,
故填:$\frac{5a-m}{m-a}$.
(4)若甲同学将装置A、B交换位置,可以通过装置D的质量变化来准确测定草酸晶体中结晶水的个数,这是因为通过D装置质量变化及其反应的化学方程式可以计算一氧化碳质量,进一步可以计算x的值.
故选:D.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

| A. | C2H6 | B. | C6H14 | C. | C8H18 | D. | C16H36 |
 某同学进行如图两个实验:
某同学进行如图两个实验:(l)甲实验中反应的化学方程式为Ba(OH)2+Na2CO3═BaCO3↓+2NaOH;
(2)乙实验观察到的现象是镁条表面出现红色固体,溶液由蓝色变成无色
(3)把甲、乙反应后的溶液倒入同一烧杯,发现有白色沉淀生成.他决定对白色沉淀的成分进行探究.
【查阅资料】硫酸钡不溶于酸.
【提出猜想】白色沉淀为:Ⅰ.Mg(OH)2;Ⅱ.Mg(OH)2和BaSO4;Ⅲ.Mg(OH)2和MgCO3.
【实验方案】
| 实验操作 | 实验现象与结论 |
| 过滤、洗涤白色沉淀备用;向白色沉淀中加入盐酸至过量 | ①若沉淀全部溶解,且无其它现象;猜想Ⅰ成立;其化学反应方程式为Mg(OH)2+2HCl=MgCl2+2H2O. ②若白色沉淀部分溶解且无气体产生,猜想Ⅱ成立. ③若沉淀完全溶解,且有气体产生,猜想Ⅲ成立. |
| A. | 碳酸钠溶液 | B. | 硫酸铜溶液 | C. | 氯化钾溶液 | D. | 石蕊试液 |